
【题目】信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)铬(24号元素) 基态原子的电子排布式为___________。
(2)CH3COCH3分子中含有________个π键,含有____________个σ键。
(3)固态氯化铬酰属于______________晶体,丙酮中碳原子的杂化方式为______________,二硫化碳属于______________(填“极性”或“非极性”)分子,分子中含有____________(填“极性”或“非极性”)键。
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有____________键。
(5)金属铬的晶胞如图所示,一个晶胞中含有_______个铬原子。

【答案】1s22s22p63s23p63d54s1(或[Ar]3d54s1) 1 9 分子 甲基碳原子sp3、羰基碳原子sp2 非极性 极性 配位 2
【解析】
(1)铬为24号元素,属于第4周期第ⅥB族,其基态原子的电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1),所以本题答案:1s22s22p63s23p63d54s1(或[Ar]3d54s1);
(2)CH3COCH3分子结构式为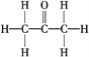 ,羰基中含有1个π键,分子中含有2个C—C σ键、6个C—H σ键、1个C—O σ键,共9个σ键,所以本题答案:1;9;
,羰基中含有1个π键,分子中含有2个C—C σ键、6个C—H σ键、1个C—O σ键,共9个σ键,所以本题答案:1;9;
(3)通过氯化铬酰常温下的熔沸点、溶解性可知其属于分子晶体;丙酮中含有两种碳原子,甲基碳原子杂化方式与甲烷碳原子相同,为sp3杂化,羰基碳原子为sp2杂化;二硫化碳为直线型分子,结构对称,属于非极性分子,其分子中只含极性键,所以本题答案:分子;甲基碳原子sp3、羰基碳原子sp2;非极性 ; 极性;
(4)K[Cr(C2O4)2(H2O)2]是配位化合物,其中肯定含有配位键,所以本题答案:配位;
(5)晶胞中显示的是9个原子,但8个位于晶胞顶点,每个顶点上的原子属于8个晶胞,故属于该晶胞的只有1/8;晶胞内的原子完全属于该晶胞,因此一个晶胞中含有2个铬原子,所以本题答案:2。


科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为了证明、比较SO2和氯水的漂白性,设计了如图所示的实验装置。

(1)实验室常选用KMnO4和浓盐酸制Cl2;选用Cu和浓硫酸反应制取SO2时,其中制SO2应选用如图A、E两发生装置中___装置(填装置序号),反应的化学方程式为___。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:___,D:___。
(3)甲乙两名同学分别利用如图所示装置探究两种气体按不同比例混合后的漂白性。

试
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:___。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:___(结合反应方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸二甲酯(DMF)俗称防霉保鲜剂霉克星1号,曾广泛应用于化妆品、蔬菜、水果等防霉、防腐、防虫、保鲜,它的一条合成路线如图所示。

回答下列问题:
(1)B的结构简式为______,D中官能团名称______。
(2)①的反应的类型是______,②的反应条件是______。
(3)④的反应方程式为______。
(4)写出C的一种同分异构体,满足可水解且生成两种产物可相互转化______。
(5)过程③由多个步骤组成,写出由C→D的合成路线_____。(其他试剂任选)(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。回答下列问题。

(1)氢氧燃料电池的能量转化主要形式是_______________________________;导线中电子流动方向为______________________(用a、b表示)。
(2)负极反应式_______________________________________________________。
(3)电极表面镀铂粉的原因____________________________________________。
(4)KOH溶液pH的变化___________(填“变大”“变小”或“不变”)。
(5)关于氢氧燃料电池,下列说法不正确的是___________。
①燃料电池的能量转化可达100%
②是一种不需要将还原剂和氧化剂全部贮存在电池内的新型发电装置
③氢氧燃料电池组合成燃料电池发电站,被人们誉为“绿色”发电站
④如果电池使用酸性电解质,负极反应式为:H2-2e-=2H+
(6)如果以N2 和H2 为反应物,以溶有A的稀盐酸为电解质溶液,可研发出既能提供电能又能固氮的新型电池,装置如下图所示。

①指出该电池的正极___________(用a、b表示)。
②物质A的化学式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的.
请回答:
(1)A原子的核外电子排布的电子排布图 ______________ ,B原子的核外电子排布式________,C原子的价电子排布式____________。
(2)A、B、C的气态氢化物的化学式分别是___________,其中最不稳定的是__________。
(3)它们的最高价氧化物的水化物中,酸性最强的是_________。
(4)AC4的化学式___________,结构式__________,中心原子A的杂化方式________杂化,是__________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法正确的是
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,水浴加热后未出现银镜 | 蔗糖未水解 |
B | 卤代烃Y与NaOH乙醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 说明卤代烃Y中含有氯原子 |
C | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清且无气体产生 | 说明苯酚的酸性强于碳酸 |
D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟喹诺酮是人工合成的抗菌药,其中间体G的合成路线如下:
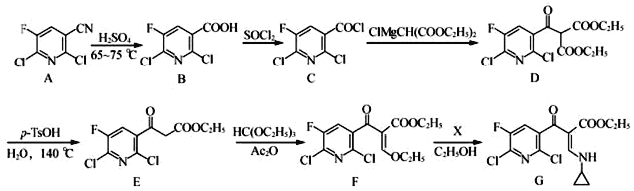
(1)G中的含氧官能团为_____和_____(填名称)。
(2)由C→D的反应类型是_____。
(3)化合物X(分子式为C3H7N)的结构简式为_____。
(4)E到F过程中的反应物HC(OC2H5)3中最多有_____个碳原子共面。
(5)B和乙醇反应的产物为H(C8H6FCl2NO2),写出该反应的化学方程式_______________ 。
写出满足下列条件的H的所有同分异构体的结构简式:_____________。
Ⅰ.是一种α﹣氨基酸;
Ⅱ.分子中有4种不同化学环境的氢,且分子中含有一个苯环。
(6)根据已有知识并结合相关信息,写出以 ![]() 和ClMgCH(COOC2H5)2为原料制备
和ClMgCH(COOC2H5)2为原料制备 的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)_____________。
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com