
分析 取7.65g Al2O3的物质的量为:$\frac{7.65g}{102g/mol}$=0.075mol,300mL 2mol/L 盐酸溶液的物质的量为:0.3×2mol=0.6mol,由Al2O3~6HCl可知,0.075mol的氧化铝消耗盐酸的物质的量为0.45mol,所以过量的盐酸的物质的量为:0.6-0.45=0.15mol,所以氢氧化钠首先与过量和盐酸反应,由此分析解答.
解答 解:取7.65g Al2O3的物质的量为:$\frac{7.65g}{102g/mol}$=0.075mol,300mL 2mol/L 盐酸溶液的物质的量为:0.3×2mol=0.6mol,由Al2O3~6HCl可知,0.075mol的氧化铝消耗盐酸的物质的量为0.45mol,所以过量的盐酸的物质的量为:0.6-0.45=0.15mol,所以氢氧化钠首先与过量和盐酸反应,
(1)盐酸消耗氢氧化钠的物质的量为:$\frac{0.15}{2}$=0.075L=75mL,故答案为:75;
(2)沉淀量达到最大值消耗氢氧化钠的体积为:75mL+$\frac{0.075mol×2×3}{2mol/L}×1000ml/L$=300mL,其沉淀质量为0.075mol×2×78g/mol=11.7g,
故答案为:300mL;11.7g.
点评 本题考查化学计算,涉及方程式的计算、混合物的计算、图象计算等,难度中等,清楚图象各段反应是解题的关键.


科目:高中化学 来源: 题型:选择题
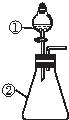 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选項 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 氢氧化钠稀溶液 | 硫酸铝铵溶液 | 立即产生白色沉淀 |
| B | 氢氧化钠浓溶液 | 用砂纸打磨过的镁条 | 立即产生大量无色气体 |
| C | 浓硫酸 | 铜粉 | 立即产生刺激性气味气体 |
| D | 盐酸 | 较浓的硝酸亚铁溶液 | 无明显现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L CuCl2溶液中含有的Cl-的个数为2NA | |
| B. | 16 g甲烷中含有的共用电子对数为NA | |
| C. | 常温常压,46 gNO2与N2O4的混合气体中含有的原子数为3NA | |
| D. | 4.6 g Na与适量氧气完全反应生成Na2O、Na2O2的混合物中含有的阴离子数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | ① | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | / | Zn+Fe2+=Zn2++Fe | ② |
| ③ | 在FeCl3溶液中加入足量铁粉 | ③ | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | ④ | / | / | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.0g熔融的NaHSO4中含有的阳离子数为0.1NA | |
| B. | 2mol SO2和1mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 常温下,5.6g Fe片投入到足量的浓硝酸中,转移电子数为0.3NA | |
| D. | 常温常压下,14g乙烯和丙烯的混合气体中含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
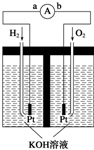 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com