
0.5L, 1mol/L FeCl3溶液中的Cl-的物质的量浓度为
A.3 mol/L B. 1.5 mol/L C.1 mol/L D. 0.5 mol/L
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) === SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) === SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) === S(正交,s) △H3
下列说法正确的是( )
A.△H3=—0.33 kJ·mol-1
B.单斜硫的能量比正交硫的能量低
C.S(单斜,s)=== S(正交,s) △H3>0,正交硫比单斜硫稳定
D.S(单斜,s)=== S(正交,s) △H3<0,单斜硫比正交硫稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2 放出热量 98 KJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2 + I- → H2O + IO- (慢); H2O2 + IO-→ H2O + O2 + I- (快)
下列有关反应的说法正确的是
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C. 反应活化能等于98 KJ•mol-1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L密闭容器中,充入a molN2和b molH2,在一定温度下N2+3H2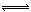 2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是 ,H2的转化率是 ,容器中H2的平衡浓度是 mol/L,该温度下平衡常数的数值为 。(用a、b、c表示出计算式即可)
2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是 ,H2的转化率是 ,容器中H2的平衡浓度是 mol/L,该温度下平衡常数的数值为 。(用a、b、c表示出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事故的处理方法正确的是
A 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭
B 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦。
C 皮肤上溅有较多的浓硫酸,赶紧用水冲洗。
D 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据阿伏加德罗定律,下列叙述中正确的是
A.同温同压下两种气体的体积之比等于摩尔质量之比
B.同温同压下两种气体的物质的量之比等于密度之比
C.同温同压下两种气体的密度之比等于摩尔质量之比
D.同温同压下两种气体的物质的量之比等于摩尔质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法中,错误的是( )
A.CCl4可由CH4制得,可萃取碘水中的碘
B.石油和天然气的主要成分都是碳氢化合物
C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
D.苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
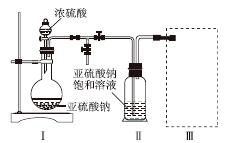
(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
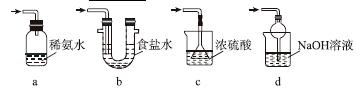
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO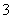 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com