
【题目】下表列出了①~⑨九种元素在周期表中的位置.
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ |
请按要求回答下列问题.
(1)这九种元素中,原子半径最大的是(填元素符号)__;元素⑤的原子结构示意图为___.
(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)______.
(3)写出元素⑧的单质与水反应的化学方程式:______.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:______.
【答案】K ![]() CH4 2K+2H2O═2KOH+H2↑ 2Cl2+2Br﹣═Br2+2Cl﹣
CH4 2K+2H2O═2KOH+H2↑ 2Cl2+2Br﹣═Br2+2Cl﹣
【解析】
由元素在周期表中位置,知①为H、②为Li、③为C、④为N、⑤为F、⑥为Si、⑦为Cl、⑧为K、⑨为Br。
(1)同周期自左而右原子半径减小、同主族自上而下原子半径增大;
⑤为F,原子核外有9个电子层,有2个电子层,各层电子数为2、7;
(2)非金属性越强,对应氢化物越稳定;
(3)K与水反应生成氢氧化钾与氢气;
(4)氯气与KBr反应生成KCl与溴单质。
由元素在周期表中位置可知,①为H、②为Li、③为C、④为N、⑤为F、⑥为Si、⑦为Cl、⑧为K、⑨为Br。
(1)同周期元素,自左而右原子半径减小,同主族元素,自上而下原子半径增大,故上述元素中K的原子半径最大;
⑤为F,原子核外有9个电子层,有2个电子层,各层电子数为2、7,原子结构示意图为![]() ;
;
(2)同周期元素,自左而右非金属性依次增强,非金属性越强,对应氢化物越稳定,故CH4的稳定性最差;
(3)K与水反应生成氢氧化钾与氢气,反应的化学方程式为:2K+2H2O═2KOH+H2↑;
(4)氯气与KBr反应生成KCl与溴单质,反应的离子方程式为:Cl2+2Br﹣═Br2+2Cl﹣。


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol/LNaOH溶液中,逐滴加入10 mL浓度为c mol/L的HF稀溶液。已知 25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7 kJ/mol ②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol。请根据信息判断,下列说法中不正确的是
A.整个滴加过程中,水的电离程度不一定存在先增大后减小的变化趋势
B.将氢氟酸溶液温度由25℃升高到35℃时,HF的电离程度减小(不考虑挥发)
C.当c>0.1时,溶液中才有可能存在c(Na+)=c(F-)
D.若滴定过程中存在:c(Na+)>c(OH-)>c(F-)>c(H+),则c一定小于0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中2 mol NO与1 mol O2充分反应,产物分子的数目为2NA
B.25℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA
C.标准状况下,22.4 L CCl4含CCl4分子数为NA
D.标准状况下,22.4L N2与CO混合气体的质量为28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)
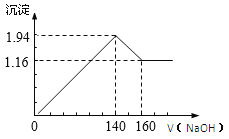
求:(1)合金中Mg,Al的质量_______________;
(2)所用HCl的物质的量浓度_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
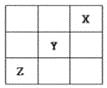
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.1molX的单质跟足量水反应时,发生转移的电子为2mol
D.Y的氢化物稳定性大于Z的氢化物稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子化合物G的合成路线如图:(部分产物及反应条件已略去)
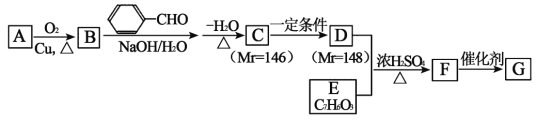
已知:①2RCH2CHO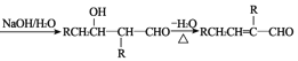
②E遇FeCl3溶液呈紫色,且能与NaHCO3溶液反应生成无色气体,其核磁共振氢谱有4组吸收峰。
回答下列问题:
(1)A的名称为___,G的结构简式为___。
(2)A→B的化学方程式为___,该反应的类型为___。
(3)C发生银镜反应的化学方程式为___。
(4)D+E→F的化学方程式为___。
(5)H为D的同分异构体,且H分子中含有(![]() ),苯环上有2个取代基,则H的可能结构有___种(不考虑立体异构),其中,能与新制氢氧化铜悬浊液反应产生砖红色沉淀且核磁共振氢谱有5组吸收峰的结构简式为___。
),苯环上有2个取代基,则H的可能结构有___种(不考虑立体异构),其中,能与新制氢氧化铜悬浊液反应产生砖红色沉淀且核磁共振氢谱有5组吸收峰的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有1L0.6mol· L-1的盐酸和 NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体的体积比为V(甲) : V(乙)= 3: 4,则加入铝粉的质量为
A.7.2 gB.5.4 gC.3.6 gD.2.7 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把5mol A和6mol B的混合气体通入4L的密闭容器中,在一定条件下发生如下反应:5A(g)+4B(g)![]() 6C(g)+xD(g),经过5min后反应达到平衡状态时,生成3mol C,并测得D的平均反应速率为0.1molL-1min-1.下列计算结果正确的是
6C(g)+xD(g),经过5min后反应达到平衡状态时,生成3mol C,并测得D的平均反应速率为0.1molL-1min-1.下列计算结果正确的是
A.x的数值是2B.A的转化率为50%
C.B的平衡浓度为2mol/LD.反应前后混合气体的压强之比为22:25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期,A基态原子的2p轨道上有2个未成对电子,C的最外层电子数是次外层电子数的3倍,C与D同主族相邻,E位于周期表的ds区,最外层只有一对成对电子。请回答下列问题:
(1)D元素在元素周期表中的位置是_____,基态E原子的电子占有_____种能量不同的原子轨道。
(2)A元素可形成多种单质,其中原子晶体的名称是_____,其每个晶胞(如图甲)实际含有_____个A原子;A有一种单质为层状结构的晶体,晶体中存在的作用力有_____,晶体中每个最小环含有_____个原子。

(3)①化合物AC2的结构式_____。
②写出用足量的氢氧化钠溶液吸收DC2气体的离子方程式_____。
(4)D与E能形成化合物X,X的一种晶体晶胞结构如图乙所示,X的化学式为_____,D离子的配位数为_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com