
【题目】短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
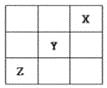
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.1molX的单质跟足量水反应时,发生转移的电子为2mol
D.Y的氢化物稳定性大于Z的氢化物稳定性
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的有( )
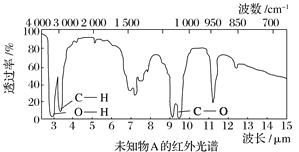
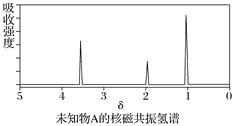
A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要意义,其反应历程示意图如图:

下列说法不正确的是( )
A.合成气的主要成分为CO和H2
B.①→②过程可表示为CO2+NiC=2CO+Ni
C.①→②过程吸收能量
D.Ni在该反应中做催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )

A.浓硫酸B.NaOH溶液C.Kl溶液D.饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,对于表中元素①~⑧,填空回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)地壳中含量最多的元素是______,非金属性最强的元素是______。
(2)写出①的最简单的气态氢化物的电子式______。
(3)在第三周期主族元素中,单质氧化性最强的是_____,能形成的二元强酸是________。
(4)写出②的气态氢化物与②的最高价氧化物对应水化物反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置.
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ |
请按要求回答下列问题.
(1)这九种元素中,原子半径最大的是(填元素符号)__;元素⑤的原子结构示意图为___.
(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)______.
(3)写出元素⑧的单质与水反应的化学方程式:______.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________,检验生成离子试剂___________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间,除铝的离子反应方程式是__________。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)氧化中除了添加适量MnO2还可以用H2O2来氧化,写出该离子反应_______________。
(6)写出“沉锰”的离子方程式_______________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
(8)写出Fe2+和HNO3的离子反应__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到100 mL某浓度HNO3中,两者恰好反应,假设反应的还原产物只有NO气体。反应后向所得溶液中加入物质的量浓度为3 mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g;则下列有关叙述中不正确的是( )
A.开始加入合金的总物质的量为0.15 mol
B.生成NO气体体积在标准状况下为2.24 L
C.生成沉淀完全时消耗NaOH溶液体积为100 mL
D.参加反应的硝酸的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2 和熔融 KNO3 可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物 Y,Y 可循环使用。下列说法正确的是
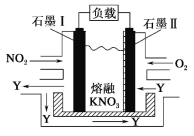
A.放电时,NO![]() 向石墨Ⅱ电极迁移
向石墨Ⅱ电极迁移
B.电池总反应式为 4NO2+O2===2N2O5
C.石墨Ⅱ附近发生的反应为 NO+O2+e- ===NO![]()
D.当外电路通过 4 mol e-,负极上共产生 2 mol N2O5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com