
【题目】将一定质量的镁铜合金加入到100 mL某浓度HNO3中,两者恰好反应,假设反应的还原产物只有NO气体。反应后向所得溶液中加入物质的量浓度为3 mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g;则下列有关叙述中不正确的是( )
A.开始加入合金的总物质的量为0.15 mol
B.生成NO气体体积在标准状况下为2.24 L
C.生成沉淀完全时消耗NaOH溶液体积为100 mL
D.参加反应的硝酸的物质的量浓度为1 mol/L
【答案】D
【解析】
将一定量的镁和铜合金加入到HNO3中,二者恰好反应,发生反应:3Mg+8HNO3(稀)═3 Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根离子的物质的量是![]() ,根据电荷守恒可知,Mg2+、Cu2+所带正电荷总数是0.3mol,根据得失电子守恒,生成NO的物质的量是0.1mol,溶液呈电中性,则和硝酸反应后的溶液中含NO3-的物质的量是0.3mol。
,根据电荷守恒可知,Mg2+、Cu2+所带正电荷总数是0.3mol,根据得失电子守恒,生成NO的物质的量是0.1mol,溶液呈电中性,则和硝酸反应后的溶液中含NO3-的物质的量是0.3mol。
A,Mg2+、Cu2+所带正电荷总数是0.3mol,则开始加入合金的总物质的量为0.3mol ÷2=0.15 mol,故A正确;
B、Mg2+、Cu2+所带正电荷总数是0.3mol,根据得失电子守恒,生成NO的物质的量是0.1mol,在标准状况下为0.1mol×22.4L/mol= 2.24 L,故B正确;
C、反应消耗氢氧根离子的物质的量是![]() ,则氢氧化钠溶液的体积是
,则氢氧化钠溶液的体积是![]() =0.1L,故C正确;
=0.1L,故C正确;
D. 根据氮元素守恒,参加反应的硝酸的物质的量是反应后的溶液中含NO3-的物质的量加NO的物质的量,硝酸的浓度是![]() 4mol/L,故D错误;
4mol/L,故D错误;
选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将含有少量杂质的硝酸铜固体用酒精灯加热至恒重,收集到20.20mL气体,再将该气体用足量水吸收,剩余2.10mL气体(气体体积在同温同压下测定),则杂质不可能
A.只是NaNO3B.只是AgNO3C.只是NaClD.是NaNO3和AgNO3的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
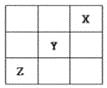
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.1molX的单质跟足量水反应时,发生转移的电子为2mol
D.Y的氢化物稳定性大于Z的氢化物稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有1L0.6mol· L-1的盐酸和 NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体的体积比为V(甲) : V(乙)= 3: 4,则加入铝粉的质量为
A.7.2 gB.5.4 gC.3.6 gD.2.7 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把5mol A和6mol B的混合气体通入4L的密闭容器中,在一定条件下发生如下反应:5A(g)+4B(g)![]() 6C(g)+xD(g),经过5min后反应达到平衡状态时,生成3mol C,并测得D的平均反应速率为0.1molL-1min-1.下列计算结果正确的是
6C(g)+xD(g),经过5min后反应达到平衡状态时,生成3mol C,并测得D的平均反应速率为0.1molL-1min-1.下列计算结果正确的是
A.x的数值是2B.A的转化率为50%
C.B的平衡浓度为2mol/LD.反应前后混合气体的压强之比为22:25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)写出H2CO3的电离方程式:__________________________________________。
(2)现有①CH3COOH、②HCl两种溶液,选择填空:
A.①>② B.①<② C.①﹦②
①当它们物质的量浓度相等时,中和等体积、等物质的量浓度的烧碱溶液需两种酸溶液的体积关系为____________。
②当它们氢离子浓度相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为____________。
II.煤化工产业中常用合成气(主要成分是氢气和一氧化碳气体)合成氨和甲醇。请回答:
(1)工业合成氨的化学方程式为N2+3H2![]() 2NH3 ,在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。则该条件下的平衡常数为________。
2NH3 ,在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。则该条件下的平衡常数为________。
(2)合成甲醇的主要反应是2H2(g)+CO(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如:
CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如:
物质 | H2 | CO | CH3OH |
浓度(mol·L-1) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率v(H2)=________。
②比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡______(填“逆向”、“正向”或“不”)移动,平衡常数K_________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是

A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2的导电能力之和大于HA的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 碳酸钙与足量浓硝酸反应:CaCO3+2H+![]() Ca2++H2O+CO2↑
Ca2++H2O+CO2↑
B. 氢氧化钠溶液与稀醋酸反应:OH-+H+![]() H2O
H2O
C. 氯化铝溶液与过量氨水反应: A13++3OH-=A1(OH)3↓
D. 钠与水反应:Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com