
【题目】已知电解熔融氯化钙可以得到金属钙和氯气。右图中钙及其化合物之间的转化按箭头方向均可一步实现。分析下列说法,其中正确的是

A. CaO、Ca(OH)2、CaCO3都含有氧元素,所以CaO、Ca(OH)2、CaCO3都属于氧化物
B. 电解熔融氯化钙得到金属钙和氯气的反应既是氧化还原反应又是化合反应
C. 工业上可利用反应4的原理将氯气通入石灰乳制漂白粉,漂白粉的主要成分是CaCl2
D. 往澄清石灰水中滴加Na2CO3溶液或NaHCO3溶液都可以实现反应6的转化
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L1NaOH溶液500 mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________________。

(2)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;
④使用之前要检查是否漏水。这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)根据计算用托盘天平称取的NaOH固体质量为______g。
(5)下面操作造成所配NaOH溶液浓度偏高的是______(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1 mol·L-1 NH4Cl溶液②0.1 mol·L-1 CH3COONH4溶液 ③0.1 mol·L-1 NH4HSO4溶液 ④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液 ⑤0.1 mol·L-1氨水
请根据要求填写下列空白:
(1)溶液①呈______(填“酸”、“碱”或“中”)性,其原因是________________(用离子方程式表示)。
(2)溶液②③中c(NH![]() )的大小关系是②___(填“>”、“<”或“=”)③。
)的大小关系是②___(填“>”、“<”或“=”)③。
(3)在溶液④中________(离子)的浓度为0.1 mol/L;NH3·H2O和________(离子)的浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”,下同)NH![]() 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH![]() 浓度的大小关系是c(CH3COO-)________c(NH
浓度的大小关系是c(CH3COO-)________c(NH![]() )。
)。
(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:______________________________。
②若溶液M由10 mL 2 mol·L-1 NaHA溶液与10 mL 2 mol·L-1 NaOH溶液混合而得,则溶液M的pH________(填“>”、“<”或“=”)7。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B===H++HB-;HB-![]() H++B2-。在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
H++B2-。在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=![]() c(Na+)
c(Na+)
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(2)下表为几种酸的电离平衡常数
CH3COOH | H2CO3 | H2S |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
则pH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序为________________,少量CO2与NaHS反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名下列有机物
(1) 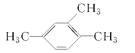 ____________________;
____________________;
(2) ____________________________;
____________________________;
(3) ![]() ____________________________;
____________________________;
(4)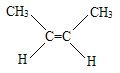 ____________________________。
____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是分属三个短周期六种主族元素,且原子序数依次增大。①B是植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染。②C和D能形成电子总数为30和38的两种化合物。③E的某种氧化物M可用做漂白剂。请回答下列问题:
(1)元素F在元素周期表中的位置是______________________________。
(2) C、D、E 三种元素原子半径由小到大的顺序是__________________(用元素符号回答); C、D、E 三种元素形成的简单离子的离子半径由小到大的顺序是__________________ (用离子符号回答)。
(3) C和D形成电子总数为38的化合物中化学键类型有__________________________(填“离子键”、“极性共价键”、“非极性共价键”)。
(4)写出D的最高价氧化物水化物的电子式______________________。
(5) E、F两种元素形成氢化物中还原性较强的是_________________(填化学式); 用电子式表示该化合物的形成过程________________________________________。
(6)C、D、F形成的某种化合物N也可用做漂白剂,M、N以物质的量1∶1混合,混合物没有漂白性。用离子方程式解释其原因_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com