
【题目】用系统命名法命名下列有机物
(1) 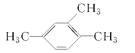 ____________________;
____________________;
(2) ____________________________;
____________________________;
(3) ![]() ____________________________;
____________________________;
(4)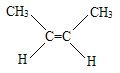 ____________________________。
____________________________。
【答案】 1,2,4—三甲苯 2—甲基—2—氯丙烷 2—丁醇 顺—2—丁烯
【解析】本题考查有机物的命名。(1)苯的同系物以苯环作为母体,烃基作为取代基,注意烃基的位次之和最小,故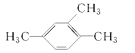 的名称为1,2,4—三甲苯;(2)卤代烃的命名选择含有卤素原子最长碳链为主链,把支链和卤素原子看作取代基,按照主链所含碳原子数目称为“某烷”,故
的名称为1,2,4—三甲苯;(2)卤代烃的命名选择含有卤素原子最长碳链为主链,把支链和卤素原子看作取代基,按照主链所含碳原子数目称为“某烷”,故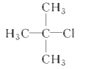 的名称为2—甲基—2—氯丙烷;(3)醇的命名选择含羟基的最长碳链,按其所含碳原子数称为某醇,并从靠近羟基的一端依次编号,写全名时,将羟基所在碳原子的编号写在某醇前面,故
的名称为2—甲基—2—氯丙烷;(3)醇的命名选择含羟基的最长碳链,按其所含碳原子数称为某醇,并从靠近羟基的一端依次编号,写全名时,将羟基所在碳原子的编号写在某醇前面,故![]() 名称为2—丁醇;(4)烯烃的命名选含有碳碳双键的最长碳链作主链,编号从靠近碳碳双键端开始,将碳碳双键所在编号小的碳原子的编号写在某烯前面,注意两个相同原子或基团在双键或脂环的同侧的为顺式,故
名称为2—丁醇;(4)烯烃的命名选含有碳碳双键的最长碳链作主链,编号从靠近碳碳双键端开始,将碳碳双键所在编号小的碳原子的编号写在某烯前面,注意两个相同原子或基团在双键或脂环的同侧的为顺式,故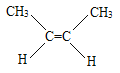 的名称为顺—2—丁烯。
的名称为顺—2—丁烯。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为__________(不写单位,用含c1、ρ1的代数式表示).
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为__________mol·L-1.
(3)将物质的量浓度分别为c2mol·L-1和1/5c2mol·L-1的氨水等质量混合,所得溶液的密度__________(填“大于”、“小于”或“等于”,下同) ρ2 g·cm-3;所得溶液的物质的量浓度__________ 3/5c2mol·L-1(设混合后溶液的体积变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如下图,关于绿原酸判断正确的是( )

A.1 mol绿原酸与足量NaHCO3溶液反应,生成3 mol CO2气体
B.1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2
C.1 mol绿原酸与足量NaOH溶液反应,最多消耗4 mol NaOH
D.绿原酸水解产物均可以与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电解熔融氯化钙可以得到金属钙和氯气。右图中钙及其化合物之间的转化按箭头方向均可一步实现。分析下列说法,其中正确的是

A. CaO、Ca(OH)2、CaCO3都含有氧元素,所以CaO、Ca(OH)2、CaCO3都属于氧化物
B. 电解熔融氯化钙得到金属钙和氯气的反应既是氧化还原反应又是化合反应
C. 工业上可利用反应4的原理将氯气通入石灰乳制漂白粉,漂白粉的主要成分是CaCl2
D. 往澄清石灰水中滴加Na2CO3溶液或NaHCO3溶液都可以实现反应6的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:

已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元索对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原于半径:r(Y)>r(Z)>r(W)
B. 化合物N、乙烯使溴水褪色的原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在生产和生活中都发挥着重要的作用。
(1)SO2是形成酸雨的主要污染物,燃煤脱硫的原理为
2CaO(s)+2SO2(s)+O2(g)![]() 2CaSO4(s)
2CaSO4(s)
向10L恒温恒容密闭容器中加入3mol CaO,并通入2mol SO2和lmol O2发生上述反应,2min时达平衡,此时CaSO4为l.8mol。02min内,用SO2表示的该反应的速率v(SO2)=_________________;其他条件保持不变,若上述反应在恒压条件下进行,达到平衡时SO2的转化率________(“填大”、“减小”或“不变”)。
(2)25℃时,H2SO3的电离常数Kal=1×10-2, Ka2=6×10-8,则该温度下NaHSO3的水解平衡常数Kb=_____________。判断NaHSO3溶液显________性(填“酸”、“碱”或“中”),用简要文字叙述原因是_______________________________。
(3)Na2SO3溶液作为吸收液可脱除烟气中的SO2。当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
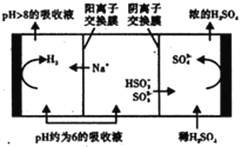
HSO3-在阳极放电时的电极反应式是________________________________。
(4)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g)![]() TaI4(g)+S2(g) △H>0
TaI4(g)+S2(g) △H>0
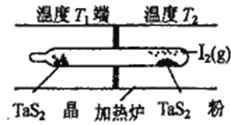
如上图所示,上述反应在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2 (g),—段时间后,在溫度为T1的一端得到了纯净的TaS2晶体,则温度T1 ______T2 (填“>”“<”或“=”)上述反应体系中循环使用的物质是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com