
【题目】中国古代记载文字的器物中,主要成分为蛋白质的是
A. 甲骨 B. 竹简 C. 丝帛 D. 青铜器
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】二价铬不稳定,极易被氧化。醋酸亚铬水合物[Cr(CH3COO)2]2.2H2O,是一种深红色晶体,微溶于乙醇,不溶于冷水和乙醚。实验室以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:

请回答下列问题:
(1)仪器A的名称是______,所盛装的试剂是_______。
(2)该实验中锌粒需过量,其原因除了与CrCl3充分反应得到CrCl2外,另一个作用是 ___________。
(3)写出C容器中制备醋酸亚铬水合物的离子方程式_______。
(4)仪器D的主要作用是_______。
(5)指出该装置的不足之处_______。
(6)Cr(OH)3的性质类似氢氧化铝,将CrCl3溶液蒸干灼烧,所得固体物质的化学式为_____。
(7)洗涤产品时,为了除去可溶性的杂质和水分,下列试剂正确使用的顺序是____(填序号)。
a.无水乙醇 b.冷的蒸馏水 c.乙醚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团水,具有饮用量少、渗透力强、生物利用率高、在人体内储存时间长、排放量少的特点。一次饮用125mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是
A.水分子的化学性质改变 B.水分子中氢氧键缩短
C.水分子间的作用力减小 D.水分子间结构、物理性质改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 苯和甲烷均不能发生氧化反应
B. 甲烷和Cl2的反应与乙烯和Br2的反应,属于同一类型的反应
C. 水煤气可用来合成液态烃及甲醇等含氧有机物
D. 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1 mol·L-1 NH4Cl溶液②0.1 mol·L-1 CH3COONH4溶液 ③0.1 mol·L-1 NH4HSO4溶液 ④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液 ⑤0.1 mol·L-1氨水
请根据要求填写下列空白:
(1)溶液①呈______(填“酸”、“碱”或“中”)性,其原因是________________(用离子方程式表示)。
(2)溶液②③中c(NH![]() )的大小关系是②___(填“>”、“<”或“=”)③。
)的大小关系是②___(填“>”、“<”或“=”)③。
(3)在溶液④中________(离子)的浓度为0.1 mol/L;NH3·H2O和________(离子)的浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”,下同)NH![]() 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH![]() 浓度的大小关系是c(CH3COO-)________c(NH
浓度的大小关系是c(CH3COO-)________c(NH![]() )。
)。
(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:______________________________。
②若溶液M由10 mL 2 mol·L-1 NaHA溶液与10 mL 2 mol·L-1 NaOH溶液混合而得,则溶液M的pH________(填“>”、“<”或“=”)7。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是

A. 图1表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
B. 图2表示除去CuSO4溶液中的Fe3+可采用加入CuO调节溶液pH到4~5
C. 图3表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,则碱性:MOH>ROH
D. 图4为KNO3和NaCl溶解度曲线,若除去NaCl中少量的KNO3,可在较高温度下制得浓溶液后,再冷却结晶、过滤、洗涤、干燥得纯净NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名下列有机物
(1) 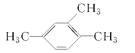 ____________________;
____________________;
(2) ____________________________;
____________________________;
(3) ![]() ____________________________;
____________________________;
(4)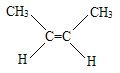 ____________________________。
____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
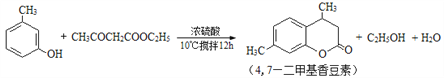
【题目】4,7—二甲基香豆素(熔点:132.6℃)是一种重要的香料。由间甲苯酚为原料合成4,7—二甲基香豆素的反应如下:
实验装置图如下:
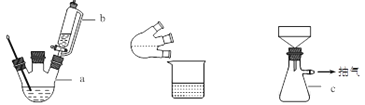
主要实验步骤:
步骤1:向装置a中加入60 mL浓硫酸,并冷却至0℃以下,搅拌下滴入间甲苯酚30 mL(0.29 mol)和乙酰乙酸乙酯26.4 mL(0.21 mol)的混合物。
步骤2:保持10℃,搅拌12 h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品。
步骤3:粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0 g。
(1)简述装置b中将活塞上下部分连通的目的_____________。
(2)装置c的名称为_____________,与过滤相比,抽滤的优点是_____________。
(3)浓硫酸需要冷却至0℃以下的原因是_____________。
(4)反应需要搅拌12 h,其原因是_____________。
(5)本次实验产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸镁在化工“新型材料”光电领域有着重要的用途。以硼泥[主要成分是MgO(52.1%),还有Fe2O3、FeO、Al2O3、SiO2等杂质]为原料设计制备偏钒酸镁的生产工艺如图所示:
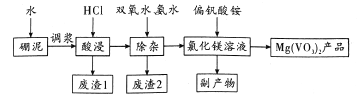
回答下列问题:
(l)Mg(VO3)2 中V的化合价为_____,副产物的电子式为_______。
(2)酸浸时,反应温度需控制在80℃,在实验室可采取的措施为______。写出”酸浸”后溶液中存在的金属阳离子_______,废渣1可用于制作_______,该物质在信息传输中具有重要应用。
(3)“除杂”过程加人双氧水的目的是_______(用离子方程式表示)。此过程中使Fe3+、Al3+浓度均小于l×10-6mol·L-1,在室温下需调节pH范围为__________[已知Ksp[Fe(OH)3]= 1×10-39, Ksp[Al(OH)]=1×10-33, pH=9.3时,Mg2+开始沉淀]。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作:__________。
(5)偏钒酸氨可由VOSO4溶液中加入氯酸钾将其氧化,然后用氨水调节pH即可制得,写出VO2+被氯酸钾氧化的离子方程式_________。
(6)现用a t硼泥生产Mg(VO3)2,若生产过程的产率为6%,则能生产出Mg(VO3)2产品的
质量为_________t (用含a、b的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com