
【题目】图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是( )
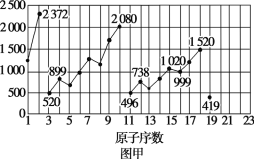
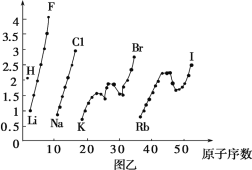
A.图甲可能表示的是元素原子的第一电离能随原子序数的变化关系B.图甲可能表示的是元素单质的熔点随原子序数的变化关系
C.图乙可能表示的是元素原子的半径随原子序数的变化关系D.图乙不可能表示同族元素的电负性随原子序数的变化关系
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】某高聚物![]() 是一种工业增塑剂,其合成路线如图所示:
是一种工业增塑剂,其合成路线如图所示:
![]()
已知![]() 的苯环上只有一个侧链,且侧链上有两种不同化学环境的氢原子;
的苯环上只有一个侧链,且侧链上有两种不同化学环境的氢原子;![]() 是芳香烃。回答下列问题:
是芳香烃。回答下列问题:
(1)![]() 中含氧官能团的名称为__________,
中含氧官能团的名称为__________,![]() 的分子式为________,
的分子式为________,![]() 的反应条件为________,
的反应条件为________,![]() 的结构简式为_________________。
的结构简式为_________________。
(2)![]() 是与
是与![]() 含有相同官能团的同分异构体,相同条件下也能制得
含有相同官能团的同分异构体,相同条件下也能制得![]() ,写出由
,写出由![]() 生成
生成![]() 的化学方程式:_______。
的化学方程式:_______。
(3)写出![]() 的化学方程式:_______。
的化学方程式:_______。
(4)![]() 的消去产物
的消去产物![]() 是一种药物中间体,下列关于
是一种药物中间体,下列关于![]() 的叙述正确的是________(填序号)。
的叙述正确的是________(填序号)。
a.能发生取代、消去、氧化、加聚反应
b.等物质的量的![]() 与
与![]() 混合,在一定条件下发生酯化反应,生成物可能的分子式为
混合,在一定条件下发生酯化反应,生成物可能的分子式为![]()
c.1molH在一定条件下与![]() 反应,最多消耗
反应,最多消耗![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素,氮是空气中含量最多的元素。
(1)![]() 中的O-H键、分子间的范德华力和氢键由强到弱的顺序依次为__________>__________>__________。
中的O-H键、分子间的范德华力和氢键由强到弱的顺序依次为__________>__________>__________。
(2)![]() 的沸点高于
的沸点高于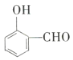 ,其原因是____________________。
,其原因是____________________。
(3)N、P、As都属于第ⅤA族元素,形成简单氢化物的沸点由高到低的顺序为__________(填分子式,下同)>__________>__________。
(4)如图1表示某种含氮有机化合物的结构简式,其分子内4个氮原子分别位于正四面体的4个顶点(见图2)。分子内存在空腔,能嵌入某种离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是__________(填标号)。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学反应因反应条件不同,可生成不同的有机产品。例如:
 (X为卤素原子)
(X为卤素原子)
苯的同系物与卤素单质混合,若在光照条件下,则苯环侧链上的氢原子被卤素原子取代;若在催化剂作用下,则苯环上的氢原子被卤素原子取代。工业上利用上述信息,按下列路线合成一种香料:
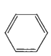
![]() A
A![]() B(一氯代物)
B(一氯代物)![]() C
C![]() D
D![]() E
E ![]()
 (香料)
(香料)
已知A的核磁共振氢谱上有5组峰,且峰面积之比为![]() 。请回答下列问题。
。请回答下列问题。
(1)A的结构简式为____________,E的结构简式为_____________。
(2)反应①的反应类型为_______,物质C中的官能团名称是________。
(3)反应③的反应条件是_______。
(4)反应④的化学方程式为_________(注明反应条件)。
(5)这种香料具有多种同分异构体,写出符合下列条件的同分异构体可能的结构简式:___________。
①含有酚羟基 ②分子中有苯环,且苯环上的一溴代物有两种 ③在一定条件下,自身能形成高聚物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 VSEPR 模型预测下列分子或离子的立体结构,其中正确的是( )
A.NH4+为正四面体形B.CS2为 V 形
C.HCN 为 V 形D.PCl3 为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
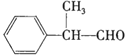
【题目】a、b、c、d、e、f为元素周期表前四周期元素,且原子序数依次增大。a原子核内无中子;在考古行业中,元素b的一种核素常用来鉴定一些文物的年代;d原子核外电子有8种不同的运动状态;e为第四周期元素,其基态原子的价电子排布式中成对电子的电子对数与单电子数相等,且每个原子轨道中都有电子;f元素的基态原子最外能层只有1个电子,且其他能层均已充满电子。回答下列问题:
(1)六种元素中电负性最大的是__(填元素符号),其中e原子的价电子排布式为__。
(2)b有多种同素异形体,其中硬度最大的是___(填名称);写出一种属于分子晶体的b的同素异形体的化学式__。
(3)a、c形成的简单分子的化学式为___,分子中c原子的杂化类型为__,分子立体构型为___。
(4)六种元素中其中有两种元素形成的化合物___(填化学式)与c的单质互为等电子体。
(5)元素d与f形成的一种化合物的晶胞结构如图所示,其中黑球在两个白球连线的中点。该化合物的化学式为__;若相邻d原子和f原子间的距离为acm,阿伏加德罗常数的值为NA,则该晶体的密度为__g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是主要的炼铜原料, CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)CuFeS2中存在的化学键类型是_________。下列基态原子或离子的价层轨道表示式正确的是_______(填标号)。
a.Fe2+:![]() b.Cu:
b.Cu:![]()
c.Fe3+:![]() d.Cu+:
d.Cu+:![]()
(2)在较低温度下 CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是________,中心原子杂化类型为______,属于________(填“非极性”或“极性”)分子。
②X的沸点比水低的主要原因是________。
(3)CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为_____,共价键的类型有________。
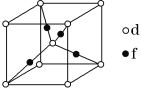
(4)四方晶系CuFeS2的晶胞结构如图所示。
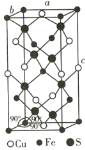
①Cu+的配位数为________,S2-的配位数为________。
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
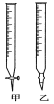
(2)本实验滴定达到终点的标志是___________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com