
【题目】a、b、c、d、e、f为元素周期表前四周期元素,且原子序数依次增大。a原子核内无中子;在考古行业中,元素b的一种核素常用来鉴定一些文物的年代;d原子核外电子有8种不同的运动状态;e为第四周期元素,其基态原子的价电子排布式中成对电子的电子对数与单电子数相等,且每个原子轨道中都有电子;f元素的基态原子最外能层只有1个电子,且其他能层均已充满电子。回答下列问题:
(1)六种元素中电负性最大的是__(填元素符号),其中e原子的价电子排布式为__。
(2)b有多种同素异形体,其中硬度最大的是___(填名称);写出一种属于分子晶体的b的同素异形体的化学式__。
(3)a、c形成的简单分子的化学式为___,分子中c原子的杂化类型为__,分子立体构型为___。
(4)六种元素中其中有两种元素形成的化合物___(填化学式)与c的单质互为等电子体。
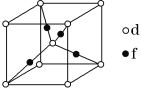
(5)元素d与f形成的一种化合物的晶胞结构如图所示,其中黑球在两个白球连线的中点。该化合物的化学式为__;若相邻d原子和f原子间的距离为acm,阿伏加德罗常数的值为NA,则该晶体的密度为__g·cm-3(用含a、NA的式子表示)。
【答案】O 3d74s2 金刚石 C60 NH3 sp3杂化 三角锥形 CO Cu2O 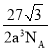
【解析】
a、b、c、d、e、f为元素周期表前四周期元素,且原子序数依次增大;a原子核内无中子,则a为H元素;元素b的的一种核素在考古时常用来鉴定一些文物的年代,则b为C元素;d原子核外电子有8种不同的运动状态,则d为氧元素,c为N元素;e为第四周期元素,其基态原子的价电子排布式中成对电子的电子对数与单电子数相等,且每个原子轨道中都有电子,则其价电子排布式为3d74s2,e为Co元素;f元素的基态原子最外能层只有一个电子,其它能层均已充满,则F原子外围电子排布为3d104s1,则f为铜元素,据此分析解题。
由分析可知a、b、c、d、e、f分别为H、C、N、O、Co、Cu元素;
(1)元素的非金属性越强,电负性越大,而六种元素中O元素非金属性最强,则电负性最大的是O,其中e原子的核电荷数为27,其价电子排布式为3d74s2;
(2)C的单质有金刚石、石墨和C60等,其中金刚石的硬度最大;C60为分子晶体;
(3)a、c形成的简单分子为NH3,其分子中N原子周围有1对孤对电子和3对成键电子,故N原子的杂化类型为sp3杂化,NH3的立体构型为三角锥形;
(4)c的单质为N2,原子数为2,价电子总数为14,与CO为等电子体;
(5)元素d与f形成的一种化合物的晶胞结构如图所示,其中黑球在两个白球连线的中点。该化合物的化学式为__;若相邻d原子和f原子间的距离为acm,阿伏加德罗常数的值为NA,则该晶体的密度为__g·cm-3(用含a、NA的式子表示)。
题给晶胞中O的个数为8×![]() +1=2,Cu的个数为4,故其化学式为Cu2O;最近的Cu和O的距离是体对角线长的
+1=2,Cu的个数为4,故其化学式为Cu2O;最近的Cu和O的距离是体对角线长的![]() ,故体对角线的长度为4a cm,边长为
,故体对角线的长度为4a cm,边长为![]() a cm,该晶体的密度为
a cm,该晶体的密度为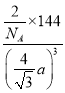 g·cm-3=
g·cm-3=![]() g·cm-3。
g·cm-3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作能达到目的的是( )
选项 | 实验目的 | 实验操作 |
A | 配制100 g10%的NaOH溶液 | 称取10 gNaOH溶于90 g蒸馏水中 |
B | 验证“84消毒液”呈碱性 | 用pH试纸测量溶液的pH |
C | 检验溶液中是否含有Na+ | 用洁净的玻璃棒蘸取溶液灼烧,观察火焰颜色 |
D | 从溴水中获得溴单质 | 利用SO2将Br2吹出后,富集、还原、分离 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、W、T的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中电负性最小,二元化合物E中元素Y和W的质量比为23:16;同周期元素简单离子中,元素Z形成的离子半径最小;T元素的价电子排布式为3d104s1。下列说法正确的是( )
A.简单离子的半径Y>Z>W
B.最高价氧化物对应水化物的酸性W>Z>X
C.W和T的单质混合加热可得化合物T2W
D.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是( )
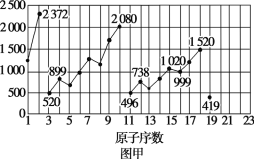
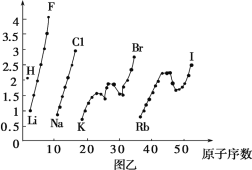
A.图甲可能表示的是元素原子的第一电离能随原子序数的变化关系B.图甲可能表示的是元素单质的熔点随原子序数的变化关系
C.图乙可能表示的是元素原子的半径随原子序数的变化关系D.图乙不可能表示同族元素的电负性随原子序数的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式如图所示,与氢气发生加成反应得到物质甲,下列有关说法错误的是( )
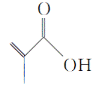
A.有机物M含有2种官能团
B.有机物M的分子式为C4H6O2
C.有机物M能发生取代反应、加聚反应
D.甲的只含有一种官能团的链状同分异构体有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下铁粉和水蒸气反应,可以得到铁的氧化物。实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。根据图示判断下列说法不正确的是( )
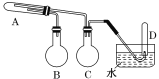
A.实验进行时试管A中应加入的试剂是铁粉
B.烧瓶B的作用是防止倒吸,烧瓶C的作用是产生水蒸气
C.试管D中收集到的是H2
D.A、B装置都需要酒精灯加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(FeCO3)是菱铁矿的主要成分,将其隔绝空气加热到200 ℃开始分解为FeO和CO2,若将其在空气中高温煅烧则生成Fe2O3。
(1)已知25 ℃、101 kPa时:
①C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
②铁及其化合物反应的焓变示意图如图:
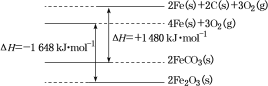
请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式:___________。
(2)据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其化学方程式为Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g)+6H2(g) ΔH
2Fe(s)+3CO(g)+6H2(g) ΔH
①反应在3 L的密闭容器中进行,2 min后达到平衡,测得Fe2O3在反应中质量减少4.8 g,则该段时间内用H2表示该反应的平均反应速率为________________。
②将一定量的Fe2O3(s)和CH4(g )置于恒温恒容密闭容器中,在一定条件下反应,能说明反应达到平衡状态的是____________。
A CO和H2的物质的量之比为1∶2
B 混合气体的密度不再改变
C 铁的物质的量不再改变
D v正(CO)=2v逆(H2)
③在容积均为V L的Ⅰ、Ⅱ、Ⅲ三个相同的密闭容器中加入足量“纳米级”的金属铁,然后分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时,CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是________;上述反应的ΔH________0(填“大于”或“小于”)。
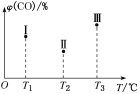
(3)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。
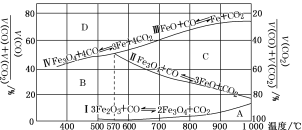
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
若在800 ℃,混合气体中CO2体积分数为40%的条件下,Fe2O3用CO还原焙烧,写出反应的化学方程式:__________。
(4)Fe2O3还可以用来制备FeCl3,通过控制条件FeCl3可生成聚合物,其离子方程式为xFe3++yH2O![]() Fex(OH)
Fex(OH)![]() +yH+。下列措施不能使平衡正向移动的是________(填字母)。
+yH+。下列措施不能使平衡正向移动的是________(填字母)。
A 加水稀释 B 加入少量铁粉
C 升温 D 加入少量Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伪麻黄碱(D)是新康泰克的成分之一,能够缓解感冒时带来的鼻塞、流鼻涕和打喷嚏等症状,其中一种合成路线如下:
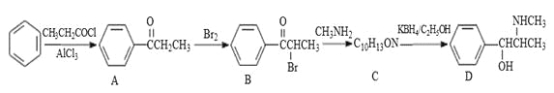
回答下列问题:
(1)伪麻黄碱(D)的分子式为 ;B中含有的官能团有 (写名称)。
(2)写出 B—C反应的化学方程式: 。C—D的反应类型为 。
(3)B的消去产物可以用于合成高分子化合物E,请写出 E的结构简式: 。
(4)满足下列要求的A的同分异构体有 种;
①能发生银镜反应
②苯环上的一氯代物有两种结构,其中核磁共振氢谱为4组峰,且峰面积之比为6:2:1:1的为 (写结构简式)。
(5)已知:![]() 。参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。参照上述合成路线,设计一条由苯和乙酸为起始原料制备![]() 的合成路线: 。
的合成路线: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
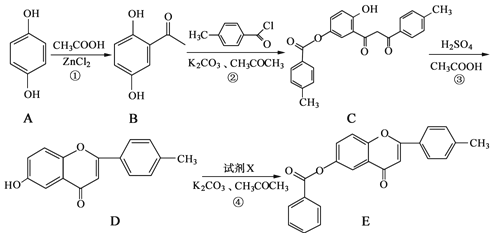
(1)化合物B中的含氧官能团的名称为_____和______。
(2)A→B的反应类型为___________。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:__________。
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应;
②分子中有4种不同化学环境的氢。
(5)已知 请写出以
请写出以![]() 和CH3COOH为原料制备
和CH3COOH为原料制备
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com