
【题目】碳酸亚铁(FeCO3)是菱铁矿的主要成分,将其隔绝空气加热到200 ℃开始分解为FeO和CO2,若将其在空气中高温煅烧则生成Fe2O3。
(1)已知25 ℃、101 kPa时:
①C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
②铁及其化合物反应的焓变示意图如图:
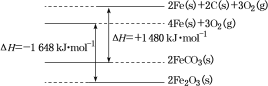
请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式:___________。
(2)据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其化学方程式为Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g)+6H2(g) ΔH
2Fe(s)+3CO(g)+6H2(g) ΔH
①反应在3 L的密闭容器中进行,2 min后达到平衡,测得Fe2O3在反应中质量减少4.8 g,则该段时间内用H2表示该反应的平均反应速率为________________。
②将一定量的Fe2O3(s)和CH4(g )置于恒温恒容密闭容器中,在一定条件下反应,能说明反应达到平衡状态的是____________。
A CO和H2的物质的量之比为1∶2
B 混合气体的密度不再改变
C 铁的物质的量不再改变
D v正(CO)=2v逆(H2)
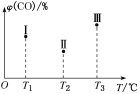
③在容积均为V L的Ⅰ、Ⅱ、Ⅲ三个相同的密闭容器中加入足量“纳米级”的金属铁,然后分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时,CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是________;上述反应的ΔH________0(填“大于”或“小于”)。
(3)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。
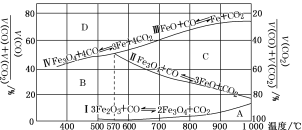
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
若在800 ℃,混合气体中CO2体积分数为40%的条件下,Fe2O3用CO还原焙烧,写出反应的化学方程式:__________。
(4)Fe2O3还可以用来制备FeCl3,通过控制条件FeCl3可生成聚合物,其离子方程式为xFe3++yH2O![]() Fex(OH)
Fex(OH)![]() +yH+。下列措施不能使平衡正向移动的是________(填字母)。
+yH+。下列措施不能使平衡正向移动的是________(填字母)。
A 加水稀释 B 加入少量铁粉
C 升温 D 加入少量Na2CO3
【答案】4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1 0.03 mol·L-1·min-1 BC Ⅲ 大于 Fe2O3+CO![]() 2FeO+CO2 B
2FeO+CO2 B
【解析】
(1)图1分析书写热化学方程式,结合C(s)+O2(g)=CO2(g)△H=-393kJmol-1和盖斯定律计算得到FeCO3在空气中煅烧生成Fe2O3的热化学方程式;
(2)①2min后达到平衡,测得Fe2O3在反应中质量减少4.8g,依据化学方程式反应前后质量变化计算生成氢气的物质的量,根据反应速率概念计算得到氢气的反应速率;
②反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变,据此分析;
③2Fe(s)+3CO(g)+6H2(g)═Fe2O3(s)+3CH4(g),根据图2中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量,由小到大,Ⅱ<Ⅰ<Ⅲ,结合化学平衡移动分析解答;根据温度对平衡的影响来判断,升高温度平衡逆向移动,CO的转化率减小,据此判断Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g)△H大小;
(3)800℃时,混合气体中CO2体积分数为40%时,图象分析可知Fe2O3用CO还原得到氧化亚铁和一氧化碳;
(4)A.加水稀释,则水解平衡正向移动;
B.固体不能影响化学平衡;
C.控制条件使平衡正向移动,水解为吸热反应,所以升温平衡正向移动;
D.加入碳酸钠,则消耗氢离子,平衡正向移动。
(1)由铁及其化合物反应的焓变示意图可推知
①4Fe(s)+3O2(g)=2Fe2O3 ΔH1=-1648 kJ·mol-1
②2FeCO3(s)=2Fe(s)+2C(s)+3O2(g)ΔH2=+1480 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH3=-393 kJ·mol-1
则在空气中煅烧FeCO3生成Fe2O3的焓变ΔH=2×ΔH2+ΔH1+4×ΔH3=2×1480 kJ·mol-1+(-1648 kJ·mol-1)+4×(-393 kJ·mol-1)=-260 kJ·mol-1,则热化学方程式为4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1;
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1;
(2)①测得Fe2O3在反应中减少的质量为4.8 g,则反应的n(Fe2O3)=![]() =0.03 mol,根据反应方程式得n(H2)=6n(Fe2O3)=6×0.03 mol=0.18 mol,则用H2表示的反应速率为v(H2)=
=0.03 mol,根据反应方程式得n(H2)=6n(Fe2O3)=6×0.03 mol=0.18 mol,则用H2表示的反应速率为v(H2)=![]() =0.03 mol·L-1·min-1;
=0.03 mol·L-1·min-1;
故答案为:0.03 mol·L-1·min-1;
②A.因为反应开始时,无CO和H2,随着反应的进行,CO和H2的物质的量之比一直为1∶2,不能说明反应达到平衡状态,故A错误;
B.该反应有固体参加,反应前后气体的质量有变化,又因为容器恒容,所以当混合气体的密度不变时,反应达到平衡状态,故B正确;
C.铁为反应物,当其质量不再改变时,反应达到平衡状态,故C正确;
D.当2v正(CO)=v逆(H2)时,反应达到平衡状态,故D错误;
综上所述,答案为BC;
③由题图可知,T1中的状态转变为T2中的状态,CO的体积分数减小,说明反应正向进行,所以状态Ⅰ未达到平衡状态;T2中的状态转变为T3中的状态,CO的体积分数增加,说明反应逆向移动,说明Ⅱ可能达到平衡状态,一定达到平衡状态的是状态Ⅲ;T3时温度最高,CO的体积分数增大,所以2Fe(s)+3CO(g)+6H2(g)=Fe2O3(s)+3CH4(g)的正反应为放热反应,则逆反应的ΔH大于0,故答案为:Ⅲ;大于;
(3)800℃时,混合气体中二氧化碳的体积分数为40%时,由图可知,在C区,此时为氧化亚铁的稳定区域,所以产物为氧化亚铁,Fe2O3用CO还原焙烧得到氧化亚铁和二氧化碳,反应的方程式为:Fe2O3+CO![]() 2FeO+CO2,故答案为:Fe2O3+CO
2FeO+CO2,故答案为:Fe2O3+CO![]() 2FeO+CO2;
2FeO+CO2;
(4)A.水为反应物,加水稀释平衡会正向移动,故A正确;
B.加入铁粉,反应物Fe3+的量减少,平衡会向逆向移动,故B错误;
C.该反应为吸热反应,所以升高温度,平衡会正向移动,故C正确;
D.加入少量Na2CO3,碳酸钠会消耗氢离子,使氢离子的浓度减小,平衡正向移动,故D正确;
综上所述,答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验方案能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验溴乙烷中的溴原子 | 加入 |
B | 检验溴乙烷发生了消去反应 | 加 |
C | 除去溴苯中的溴 | 用 |
D | 确定乙醇分子的结构 | 通过质谱仪进行质谱分析 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 VSEPR 模型预测下列分子或离子的立体结构,其中正确的是( )
A.NH4+为正四面体形B.CS2为 V 形
C.HCN 为 V 形D.PCl3 为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f为元素周期表前四周期元素,且原子序数依次增大。a原子核内无中子;在考古行业中,元素b的一种核素常用来鉴定一些文物的年代;d原子核外电子有8种不同的运动状态;e为第四周期元素,其基态原子的价电子排布式中成对电子的电子对数与单电子数相等,且每个原子轨道中都有电子;f元素的基态原子最外能层只有1个电子,且其他能层均已充满电子。回答下列问题:
(1)六种元素中电负性最大的是__(填元素符号),其中e原子的价电子排布式为__。
(2)b有多种同素异形体,其中硬度最大的是___(填名称);写出一种属于分子晶体的b的同素异形体的化学式__。
(3)a、c形成的简单分子的化学式为___,分子中c原子的杂化类型为__,分子立体构型为___。
(4)六种元素中其中有两种元素形成的化合物___(填化学式)与c的单质互为等电子体。
(5)元素d与f形成的一种化合物的晶胞结构如图所示,其中黑球在两个白球连线的中点。该化合物的化学式为__;若相邻d原子和f原子间的距离为acm,阿伏加德罗常数的值为NA,则该晶体的密度为__g·cm-3(用含a、NA的式子表示)。
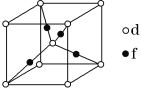
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙烯通过聚合反应可得到高分子材料
B. 聚丙烯的结构单元是—CH2-CH2-CH2—
C. 碳纤维属于合成有机高分子化合物
D. 聚乙烯塑料的老化是因为发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是主要的炼铜原料, CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)CuFeS2中存在的化学键类型是_________。下列基态原子或离子的价层轨道表示式正确的是_______(填标号)。
a.Fe2+:![]() b.Cu:
b.Cu:![]()
c.Fe3+:![]() d.Cu+:
d.Cu+:![]()
(2)在较低温度下 CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是________,中心原子杂化类型为______,属于________(填“非极性”或“极性”)分子。
②X的沸点比水低的主要原因是________。
(3)CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为_____,共价键的类型有________。
(4)四方晶系CuFeS2的晶胞结构如图所示。
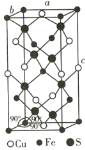
①Cu+的配位数为________,S2-的配位数为________。
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼原子的价电子排布图为____________。
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________。
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B__________N(填“>”“<”或“=”,下同)。H2N―→BH2中B原子的杂化类型为________。
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是________;写出制备反应的化学方程式:____________。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。
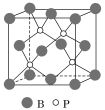
①磷化硼晶体属于______________晶体(填晶体类型),____________(填“是”或“否”)含有配位键。
②晶体中P原子的配位数为____________。
③已知BP的晶胞边长为a nm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度为____________g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )
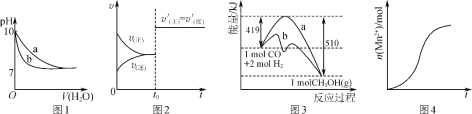
A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)![]() CH3OH(g),该反应的ΔH=-91 kJ·mol-1
CH3OH(g),该反应的ΔH=-91 kJ·mol-1
D.图4表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:
NH3+H3BO3=NH3·H3BO3;
NH3·H3BO3+HCl= NH4Cl+ H3BO3。
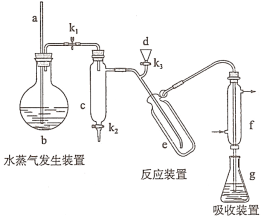
回答下列问题:
(1)a的作用是_______________。
(2)b中放入少量碎瓷片的目的是____________。f的名称是__________________。
(3)清洗仪器:g中加蒸馏水:打开k1,关闭k2、k3,加热b,蒸气充满管路:停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________;打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水,打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是___________________。
②e中主要反应的离子方程式为________________,e采用中空双层玻璃瓶的作用是________。
(5)取某甘氨酸(C2H5NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸V mL,则样品中氮的质量分数为_________%,样品的纯度≤_______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com