
����Ŀ������ͼʾ���Ӧ������������ϵ��ǣ�������
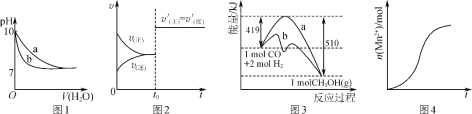
A.ͼ1��ʾ��ͬ�¶��£���pH��10������������Һ�Ͱ�ˮ�зֱ��ˮϡ��ʱpH�仯���ߣ�����a��ʾ��ˮϡ��ʱpH�ı仯����
B.ͼ2��ʾ�Ѵ�ƽ���ij��Ӧ����t0ʱ�ı�ijһ������Ӧ������ʱ��仯����ı������һ���Ǽ������
C.ͼ3��ʾ��ҵ����CO�����״��ķ�ӦCO(g)��2H2(g)![]() CH3OH(g)���÷�Ӧ����H����91 kJ��mol��1
CH3OH(g)���÷�Ӧ����H����91 kJ��mol��1
D.ͼ4��ʾ10 mL 0.01 mol��L��1����KMnO4��Һ�������0.1 mol��L��1H2C2O4��Һ���ʱ��n(Mn2��)��ʱ��ı仯(Mn2���Ը÷�Ӧ�д�����)
���𰸡�B
��������
A��pH��ͬ��ǿ���������Һ��ϡ�����У���ϡ�����л�ٽ�һˮ�ϰ��ĵ��룬���pH�仯���������������Һ�������a��ʾ��ˮϡ��ʱpH�ı仯���ߣ���A���������⣻
B�����ÿ��淴ӦΪ����������Ӧ������ѹǿʱ�����淴Ӧ���ʾ�����ƽ�ⲻ�����ƶ�����һ���Ǽ����˴�������B�������⣻
C����ͼ��֪���÷�Ӧ���ʱ���H=(419-510)kJ/mol=-91kJ/mol����C���������⣻
D���ζ������У����ŷ�Ӧ�Ľ��У��������е�Mn2+�����ӣ���Mn2���Ը÷�Ӧ�д����ã���˻�ѧ��Ӧ���������ӣ�Mn2+�������ʽϿ죬����Ӧ��Ũ�����ͣ��������ʽ��������ո��������ȫ��Ӧ��Mn2+�������ӣ���D���������⣻
�ʴ�Ϊ��B��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��Ϊ�����ʻ�ѧԪ�����ڱ���������ͼ��ʾ��Ԫ�����ڱ���һ���֣�W��X��Y��ZΪ����������Ԫ�أ�W��X������ϼ�֮��Ϊ8������˵������ȷ����
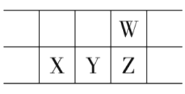
A.ԭ�Ӱ뾶��W<X
B.��̬�⻯�����ȶ��ԣ�Z<W
C.Y���ʿ������뵼�����
D.X������������ˮ������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܡ������ء���ĵ��ʼ��仯��������������������Ҫ��Ӧ�á��ش��������⣺
(1)д�� As �Ļ�̬ԭ�ӵĵ����Ų�ʽ_____��
(2)�� NaNO3 �� Na2O ��һ�������·�Ӧ�õ�һ�ְ�ɫ���壬��֪������������ SO42-��Ϊ�� �����壬��������ӵĻ�ѧʽ��_____��
(3)Fe3+��Co3+�� N3-��CN-�ȿ��γ�������ӡ�
��K3[Fe(CN)6]�����ڼ��� Fe2+,���� CN-��̼ԭ���ӻ��������Ϊ_____��
��[Co(N3)(NH3)5]SO4 �� Co ����λ��Ϊ_____,���������к��еĻ�ѧ������Ϊ___(�����Ӽ������ۼ�����λ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�� ��H=-akJ/mol
��H=-akJ/mol
����˵������ȷ���ǣ� ��
A.˳-2-��ϩ�ȷ�-2-��ϩ�ȶ�
B.˳-2-��ϩ���ӱȷ�-2-��ϩ����������
C.��������������˳-2-��ϩ
D.�����ʵ�����˳-2-��ϩ�ͷ�-2-��ϩ�ֱ�������������Ӧ���ų����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00mL0.1000mol��L-1�Ĵ�����Һ����μ���0.1000mol��L-1��NaOH��Һ��pH��NaOH��Һ����ı仯��ͼ��ʾ������˵������ȷ���ǣ� ��
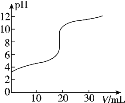
A.�ڵζ������У�c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.pH=5ʱ��c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.pH=7ʱ������NaOH��Һ�����С��20.00mL
D.�ڵζ������У���NaOH��Һ�μ�c(CH3COO-)��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2�ǵ�����ȡ֮������֮���ߵ�̼Դ����CO2Ӧ����������ʵ�����ۺ�������Ŀǰ���о��ȵ㡣
��1����CO2ת��Ϊ������CO2��Դ�����õ���Ҫ������
I.�ڴ���������CO2��CH4ת��ΪCH3COOH�ķ�Ӧ����ʾ��ͼ��ͼ��
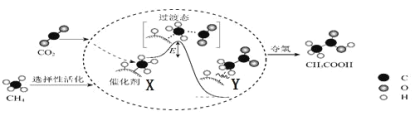
���ںϳ�CH3COOH�ķ�Ӧ�����У������й�˵����ȷ����_____��������ĸ��
a.�ô���ʹ��Ӧ��ƽ�ⳣ������
b.CH4��CH3COOH��������C��H����������
c.��X��Y�����зų��������γ���C��C��
�ڸ���������CO2��CH4�ϳ�CH3COOH�Ļ�ѧ����ʽΪ_____��
II.��ⷨת��CO2��HCOOH��ԭ����ͼ��

��д������CO2��ԭΪHCOO-�ĵ缫��Ӧʽ��_____��
�ڵ��һ��ʱ�����������KHCO3��ҺŨ�Ƚ��ͣ���ԭ����_____��
��2����CO2�ϳɼ״���CO2��Դ�����õ���Ҫ�������о������ڴ���������CO2��H2�ɷ�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H
CH3OH(g)+H2O(g) ��H
����������ߺϳ�CH3OH��Ӧ��CO2��ƽ��ת���ʵĴ�ʩ��_____��������ĸ��
a.ʹ�ô��� b.��ѹ c.�����ʼͶ�ϱ�![]()
���о��¶ȶ��ڼ״����ʵ�Ӱ�졣��210��~290�汣��ԭ������CO2��H2��Ͷ�ϱȲ��䣬�õ��״���ʵ�ʲ��ʡ�ƽ��������¶ȵĹ�ϵ��ͼ��ʾ����H____0������������������������������____��
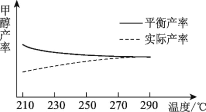
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ3 L���ܱ������У�һ����̼��������Ӧ���ɼ״�(����ΪCu2O/ZnO)��CO(g)��2H2(g)CH3OH(g)��
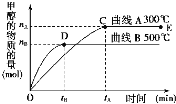
��������������и��⣺
(1)��Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK��__________�������¶ȣ�Kֵ__________(����������������С������������)��
(2)��500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��______________��
(3)�������������������£��Դ���E�����ϵ���ѹ����ԭ����1/2�������йظ���ϵ��˵����ȷ����__________(����ĸ���)��
a.������Ũ�ȼ�С b.����Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ�
c.�״������ʵ������� d.����ƽ��ʱn(H2)/n(CH3OH)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t��ʱ,��20.00mL0.1mol/L��Ԫ����H2X��Һ�е���0.1mol/LNaOH��Һ,��Һ����ˮ�������cˮ(OH-)�ĸ�����[-lgc ˮ(OH-)]������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ������˵���в���ȷ����
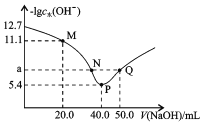
A.M����Һ��:c(Na+)>c(HX-)>c(H2X)
B.P����Һ��: c(OH-)-c(H+)=c(HX-)+2c(H2X)
C.��Һ��![]()
D.ˮ�ĵ���̶�:P>N=Q>M,��a=7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��.�±��Ǵ�ʵ���в�õIJ�ͬ�������������ļ����ͼ������ݣ�
������ |
|
|
|
|
���� | 149 | 128 | 121 | 112 |
���� |
|
|
|
|
����![]() ��
��![]() ��ֵ��δ�ⶨ�����ɸ��ݹ����Ƶ�
��ֵ��δ�ⶨ�����ɸ��ݹ����Ƶ�![]() ��
��![]() ��
��![]() ��
��![]() �Ĵ�С˳����
�Ĵ�С˳����![]() ���ù����ǣ� ��
���ù����ǣ� ��
A.�ɼ�ʱ��������Խ�࣬����Խ��
B.����Խ�̣�����Խ��
C.�ɼ����õ�����Խ�٣�����Խ��
D.�ɼ�ʱ���Ӷ�Խƫ�ƣ�����Խ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com