
| A. |  滴加液体 | B. |  取用固体 | C. |  测溶液pH | D. |  过滤 |
分析 A.滴加液体时,滴定管应该悬空,不能接触试管;
B.取药品时,瓶盖应该倒扣在桌面上;
C.用pH试纸测量液体的pH值时,先把pH试纸放在点滴板上,再用胶头滴管吸取待测液滴到pH试纸,与标准比色卡对照,读数即可;
D.过滤时,要用玻璃棒引流,且漏斗低端要紧靠烧杯内壁.
解答 解:A.滴加液体时,滴定管应该悬空,不能接触试管,否则会污染药品,故A错误;
B.取药品时,瓶盖应该倒扣在桌面上,根据图知该操作错误,故B错误;
C.用pH试纸测量液体的pH值时,先把pH试纸放在点滴板上,再用胶头滴管吸取待测液滴到pH试纸,与标准比色卡对照,读数即可,操作正确,故C正确;
D.过滤时,要用玻璃棒引流,且漏斗低端要紧靠烧杯内壁,所以操作错误,故D错误;
故选C.
点评 本题考查化学实验方案评价,侧重考查基本操作,为高频考点,明确操作规范性是解本题关键,易错选项是A,注意:制取氢氧化亚铁沉淀时胶头滴管必须伸入液面下.


科目:高中化学 来源: 题型:解答题
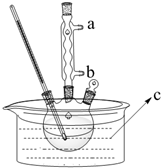 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+有氧化性 | 实验室常用KSCN溶液检验Fe3+ |
| B | SO2有较强的还原性 | SO2可使酸性KMnO4溶液褪色 |
| C | 浓硫酸可干燥NO和SO2 | NO和SO2还原性都弱 |
| D | 浓硫酸有吸水性 | 浓硫酸可用于干燥氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通惰性气体增大压强,平衡正向移动 | |
| B. | 再加入X,反应吸收的热量增大 | |
| C. | 增加Y的物质的量,X的转化率减小 | |
| D. | 降低温度,c(Y):c(Z)的值变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | C的体积分数下降 | ||
| C. | 平衡向逆反应反向移动 | D. | A的转化率变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| D. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g 氧气,转移2NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com