
| A. | 通惰性气体增大压强,平衡正向移动 | |
| B. | 再加入X,反应吸收的热量增大 | |
| C. | 增加Y的物质的量,X的转化率减小 | |
| D. | 降低温度,c(Y):c(Z)的值变小 |
分析 A、恒容条件下,通入稀有气体使压强增大,反应混合物的浓度不变,正、逆反应速率不变;
B、反应吸收的热量与反应物的物质的量成正比;
C、增加反应物的物质的量,平衡正向移动;
D、降低温度,化学平衡向着放热方向进行.
解答 解:A、恒容条件下,通入稀有气体使压强增大,反应混合物的浓度不变,正、逆反应速率不变,平衡不移动,故A错误;
B、反应吸收的热量与反应物的物质的量成正比,再加入X,反应吸收的热量增大,故B正确;
C、增加Y的物质的量,平衡正向移动,X的转化率增大,故C错误;
D、降低温度,化学平衡向着放热方向进行,即向逆方向进行,$\frac{c(Y)}{c(Z)}$的值变大,故D错误.
故选:B.
点评 本题考查学生影响化学平衡移动的因素:温度、浓度、压强等,注意化学反应的焓变的影响因素,难度不大.


科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
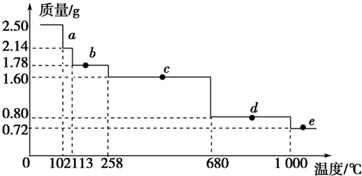
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -74.8kJ.mol-1 | B. | +74.8kJ.mol-1 | C. | -149.6kJ.mol-1 | D. | +149.6kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
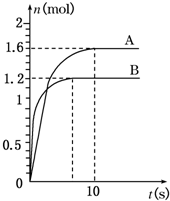
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com