
【题目】已知相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断 裂时需要吸收的能量/kJ | 436 | 230 | 369 |
H2(g)+Br2(g)=2HBr(g) ΔH=-akJ/mol则a是
A.404 B.72 C.230 D.200
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含6.02×1023个氮原子
C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下的22.4L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA
C.7.8 g Na2O2含有的阴离子数目为0.1 NA
D.80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已达到电离平衡的1 mol·L-1的醋酸溶液中,欲使醋酸电离程度增大,同时使溶液的pH 增大,应采取的措施是( )
A. 通入少量HCl气体 B. 加热
C. 加少量醋酸钠晶体 D. 加少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以100℃预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是______(用离子方程式表示)
(2)步骤②的反应瓶材质可能是____(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反应的化学方程式为________
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成Fe3十,然后把溶液蒸干,灼烧至恒重得9. 6 g固体,则该铁氧体的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①步骤Ⅰ加入Sn粉的作用:__________________及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________。
③步骤Ⅲ生成SnO的离子方程式:__________________________。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是:______________________,证明已洗净。
⑤步骤Ⅴ操作依次为____________、____________、过滤、洗涤、低温干燥。
(2)某化学兴趣小组对用于微电子器件生产的锡粉进行了纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
①写出步骤②加入Fe2(SO4)3发生反应的离子方程式:____________________;
②此锡粉样品中锡的质量分数为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
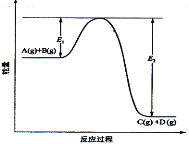
(1)该反应是__________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),原因是__________________;
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于放热反应的是
A.灼热的碳与二氧化碳的反应 B.盐酸与烧碱溶液的反应。
C.乙醇在空气中的燃烧 D.氢氧化钡晶体与氯化铵晶体在常温下的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com