
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
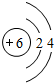 .
.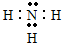 .
.分析 根据元素在周期表中的相对位置可知,A为H元素、B为He、C为Na、D为C、E为N、F为O、G为Si、H为Cl元素,
(1)有机物中都含有C原子,所以碳元素形成的化合物种类最多;
(2)非金属性越强,对应气态氢化物的稳定性越强,根据二者的非金属性判断;
(3)A为H、E为N,二者形成的极易溶于水的化合物为氨气,氨气为共价化合物,分子中存在3个氮氢键,据此写出其电子式;
(4)氯气与水反应生成氯化氢和次氯酸,所以氯水显示酸性,同时生成的次氯酸具有漂白性;
(5)过氧化钠和二氧化碳反应生成氧气,过氧化钠可以做呼吸的供氧剂;
(6)反应方程式为:N2H4+2H2O2=N2+4H2O,32g肼的物质的量为1mol,写出热化学方程式即可.
解答 解:根据元素在周期表中的相对位置可知,A为H元素、B为He、C为Na、D为C、E为N、F为O、G为Si、H为Cl元素,
(1)上述元素A、B、D、E、F中形成化合物种类最多的一种元素为C元素,C的原子序数为6,其原子结构示意图为: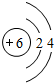 ,故答案为:
,故答案为: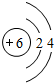 ;
;
(2)D的氢化物为甲烷,G的氢化物硅烷,非金属性:C>Si,非金属性越强,对应的气态氢化物越稳定,则气态氢化物D的氢化物>G的氢化物,故答案为:>;
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物为氨气,氨气为共价化合物,氨气电子式为: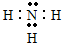 ,故答案为;
,故答案为;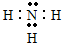 ;
;
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该单质为氯气,氯气与水反应生成氯化氢和次氯酸,反应的离子方程式为:Cl+H2O?H++Cl-+HClO,故答案为:Cl+H2O?H++Cl-+HClO;
(5)过氧化钠和二氧化碳反应生成氧气,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2;为稀释氧气,制造一种适合宇航员生存的人工生态环境,可以在飞船中加氮气,制造类似空气的环境,氮气的结构式为N≡N,故答案为:2Na2O2+2CO2═2Na2CO3+O2;N≡N;
(6)32故肼的物质的量为:$\frac{32g}{32g/mol}$=1mol,所以反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-567.85kJ/mol,故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-567.85kJ/mol.
点评 本题考查元素周期表与元素周期律的综合应用,题目难度中等,熟悉元素在周期表中的位置并推出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质即可解答.


科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | |
| B. | 葡萄糖在人体内氧化分解 | |
| C. | 锌粒与稀H2SO4反应制取H2 | |
| D. | 二氧化碳与赤热的炭反应生成一氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘-131原子核外有5个电子层 | |
| B. | 碘-131原子的最外层有7个电子 | |
| C. | 具有放射性的碘-131原子比普通碘-127原子多4个中子 | |
| D. | 131I2与127I2互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
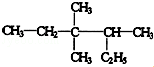 3,3,4-三甲基已烷分子结构中有1个手性碳原子.
3,3,4-三甲基已烷分子结构中有1个手性碳原子. ,
,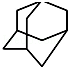 的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升.
的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的I1大于Y 的I1 | B. | X的电负性小于Y的电负性 | ||
| C. | X的阴离子半径小于Y的阳离子半径 | D. | X的原子半径大于Y的原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Na2CO3固体加入新制的氯水中,有无色气泡(H+) | |
| B. | 向淀粉KI溶液中滴加新制氯水,溶液变蓝(Cl2) | |
| C. | 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-) | |
| D. | 新制氯水使红色布条褪色(HCl) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com