
| A. | C2H4 和C2H6 | B. | CH4和C3H6 | C. | C3H8和C2H4 | D. | CH4 和C2H4 |
分析 由气态烷烃和气态单烯烃组成的混合气体是同种状况下H2密度的13倍,则M(混合)=13×2g/mol=26g/mol,
烯烃的摩尔质量最小为28g/mol,
则烷烃的摩尔质量应小于26g/mol,所以混合气体中一定含有甲烷,
设烯烃的化学式为CnH2n,标准状况下该混合气体6.72L,溴水增重7g,
则n(混合)=$\frac{6.72L}{22.4L/mol}$=0.3mol,混合气体质量为0.3mol×26g/mol=7.8g,
则甲烷的质量为7.8g-7g=0.8g,甲烷的物质的量为$\frac{0.8g}{16g/mol}$=0.05mol,
则烯烃的物质的量为0.3mol-0.05mol=0.25mol,
所以M(CnH2n)=$\frac{7g}{0.25mol}$=28g/mol,12n+2n=28,
解得n=2,
即烯烃为乙烯,由此分析解答.
解答 解:由气态烷烃和气态单烯烃组成的混合气体是同种状况下H2密度的13倍,则M(混合)=13×2g/mol=26g/mol,
烯烃的摩尔质量最小为28g/mol,
则烷烃的摩尔质量应小于26g/mol,所以混合气体中一定含有甲烷,
设烯烃的化学式为CnH2n,标准状况下该混合气体6.72L,溴水增重7g,
则n(混合)=$\frac{6.72L}{22.4L/mol}$=0.3mol,混合气体质量为0.3mol×26g/mol=7.8g,
则甲烷的质量为7.8g-7g=0.8g,甲烷的物质的量为$\frac{0.8g}{16g/mol}$=0.05mol,
则烯烃的物质的量为0.3mol-0.05mol=0.25mol,
所以M(CnH2n)=$\frac{7g}{0.25mol}$=28g/mol,12n+2n=28,
解得n=2,
即烯烃为乙烯,该混合物为甲烷与乙烯.
故选D.
点评 本题考查平均摩尔质量、加成反应等计算,明确混合气体的摩尔质量介于烷烃和烯烃之间得出甲烷是解答本题的关键,难度不大.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
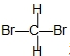 和
和 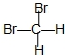
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:4 | |
| B. | O2F2既是氧化剂又是还原剂 | |
| C. | 若生成4.48 L HF,则转移0.8 mol电子 | |
| D. | 氧气是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Ba2+、Cl-、NO3- | B. | K+、OH-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成a mol A的同时消耗2a mol C | |
| B. | 混合气体的压强不再变化 | |
| C. | 单位时间内消耗a mol A的同时消耗a mol B | |
| D. | B气体的浓度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1 的 NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与 0.1 mol•L-1NaOH 溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| C. | CH3COONa 和 CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 含等物质的量的 NaHC2O4和 Na2C2O4的溶液:2 c(Na+)=3c(HC2O4-)+3c(C2O42-)+3c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗净的容量瓶中残留少量的蒸馏水 | B. | 溶解NaOH的烧杯未洗净 | ||
| C. | 称量NaOH时使用称量纸 | D. | 定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 |
| 金刚石:3550 | Li:181 | HF:-83 | NaCl:801 |
| 硅晶体:1410 | Na:98 | HCl:-115 | KCl:776 |
| 硼晶体:2300 | K:64 | HBr:-89 | RbCl:718 |
| 二氧化硅:1723 | Rb:39 | HI:-51 | CaCl:645 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com