
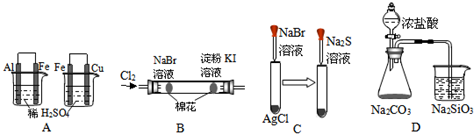
| 实验 | 现象 | 结论 |
| A | 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变橙色,右边棉花变蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为浅黄色,后变为黑色 | 溶解性:AgCl<AgBr<Ag2S |
| D | 锥形瓶中有气体产生,烧杯中溶液变浑浊 | 酸性:盐酸>碳酸>硅酸 |
| A、A | B、B | C、C | D、D |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| n/mol | 8.00 | 12.00 | 1.00 | 3.00 |
| A、甲实验达到平衡时,反应吸收的热量为81.6kJ |
| B、乙实验中当HCOOCH3、H2O的浓度分别为1.00mol/L、1.00mol/L时反应达平衡状态 |
| C、乙实验中甲酸甲酯的平衡转化率大于甲实验中甲酸甲酯的平衡转化率 |
| D、若要使达到平衡时甲实验和乙实验的混合气体中甲酸的百分含量相同,可采取的措施是降低甲的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HC≡CCH(CH3)C(CH3)3 |
| B、CH2=CHC(CH3)2CH(CH3)2 |
C、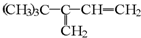 |
| D、(CH3)3CC(CH3)=CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和HCN都易形成白雾 |
| B、(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O |
| C、NaCN和AgCN都易溶于水 |
| D、MnO2可与浓HCN溶液反应生成(CN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | ||||
| B、铝粉与NaOH的D2O溶液反应:2Al+2OH-+2D2O═2AlO2-+H2↑+2D2↑ | ||||
| C、5.6g Fe与200mL 2.0 mol/L HNO3溶液充分反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O | ||||
D、三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体Fe3++3H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应是旧键断裂和新键形成的过程 |
| B、盖斯定律实质上是能量守恒定律的体现 |
| C、反应前后分子数不变遵循的是质量守恒定律 |
| D、溶解平衡、水解平衡和电离平衡均为动态平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com