
【题目】某温度下,水的离子常数KW=10—13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计。
(1)若所得混合溶液为中性,则a:b=________,生成沉淀物质的量为______mol(用含b表达式来表示)。
(2)若a:b=9:2,则所得溶液pH=_____。该混合溶液最多能溶解铁粉_______g(用含a、b表达式表示)。
【答案】(1)10:1;0.05b;(2)2;0.28(a+b)
【解析】
试题分析:某温度时,水的离子积常数KW=10-13,pH=11的Ba(OH)2溶液中氢氧根离子浓度为0.01mol/L,pH=1的H2SO4溶液中氢离子浓度为0.1mol/L,
(1)若所得混合液为中性,酸碱恰好完全反应,则有:n(H+)=n(OH-),即:0.01mol/L×aL=0.1mol/L×bL,a:b=0.1:0.01=10:1,Ba2++SO42-=BaSO4↓,用硫酸根计算沉淀物质的量=![]() ×bL=0.05bmol;或用钡离子计算沉淀物质的量=
×bL=0.05bmol;或用钡离子计算沉淀物质的量=![]() ×aL=0.005amol;故答案为:10:1;0.05bmol或0.005amol;
×aL=0.005amol;故答案为:10:1;0.05bmol或0.005amol;
(2)若a:b=9:2,而a:b=10:1时二者恰好反应,说明酸过量,若所得混合液的pH=2,酸过量,c(H+)=![]() ,将a=
,将a=![]() b代入可得,c(H+)=0.01mol/L,溶液pH=2;铁与氢离子反应的关系式为:Fe~2H+,n(Fe)=
b代入可得,c(H+)=0.01mol/L,溶液pH=2;铁与氢离子反应的关系式为:Fe~2H+,n(Fe)=![]() n(H+),所以该溶液最多溶解的铁的质量为:m(Fe)=56g/mol×
n(H+),所以该溶液最多溶解的铁的质量为:m(Fe)=56g/mol×![]() 0.01mol/L×(a+b)L=0.28(a+b)g,a:b=9:2时所得溶液的pH为2;该混合溶液最多能够溶解铁粉的质量为0.28(a+b)g,故答案为:2;0.28(a+b)。
0.01mol/L×(a+b)L=0.28(a+b)g,a:b=9:2时所得溶液的pH为2;该混合溶液最多能够溶解铁粉的质量为0.28(a+b)g,故答案为:2;0.28(a+b)。


科目:高中化学 来源: 题型:
【题目】石蜡油(主要是含17个碳原子以上的液态烷烃混合物)分解实验按照右图进行:
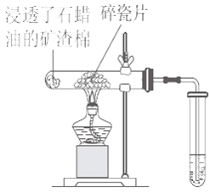
(1)石蜡油分解实验产生的气体的主要成分是 (填写序号)。
①只有甲烷 ②只有乙烯 ③烷烃跟烯烃的混合物。
(2)将石蜡油分解所得生成物通入到酸性高锰酸钾溶液中,现象是 。
(3)碎瓷片的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)1-丁烯与溴水的反应 。
(2)相对分子质量为72的某烃,其一氯代物只有一种,则该烃的一氯代物的结构简式为_________。
(3)用系统命名方法命名下列有机化合物
(CH3)2CHCH(CH3)2_____________________________;
 ______________________________;
______________________________;
(4)已知结构式为 的物质互为同分异构体,我们称之为顺反异构。则分子式为C5H10的有机物,属于烯烃的同分异构体的数目为_________种(考虑顺反异构)。
的物质互为同分异构体,我们称之为顺反异构。则分子式为C5H10的有机物,属于烯烃的同分异构体的数目为_________种(考虑顺反异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】、近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关。与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象。臭氧浓度升高是光化学烟雾形成的标志。请回答下列相关问题:
(1)以下可能引起细颗粒物指标变高的是 (填序号)。
a.燃煤取暖 b.大型交通设备 c.生活污水 d.火山喷发 e.局部战争 f.采矿业
(2)下图是某地光化学烟雾的日变化曲线:据图所示,
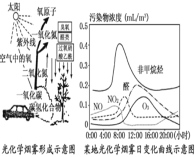
上午8:00,非甲烷烃和NO出现峰值。 随后NO2约于10:00达峰值,其主要反应的方程式可能为 。8:00起,O3开始积累,并于13:00达峰值,O3积累与下列过程有关: O+O2 →O3,该反应物中游离的氧原子主要是由反应: 产生的。O3又使10:00前NO2的含量急剧增加,其化学方程式为 。你认为该地光化学烟雾较严重的时间最可能为 (填序号)。
a.8:00 b.10:00 c.15:00 d.20:00
(3)若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2 与N2O4的平衡混合物密度为3.18 g/L时,混合气体的平均摩尔质量为 ,N2O4的分解率(即转化率)为 。(计算结果均保留三位有效数字)。
(4)NO、NO2、NH4+及NO2-等被称为活性氮物质,超量排放会引起环境问题。NH4+与NO2-可发生下列反应:NH4+(aq)+NO2-(aq) ![]() N2(g)+2H2O(l)可加快该反应的措施为 。该反应的反应速率方程为ν = k·c(NH4+)x·c(NO2-)y,其中k为速率常数,在一定温度下,进行下列实验:
N2(g)+2H2O(l)可加快该反应的措施为 。该反应的反应速率方程为ν = k·c(NH4+)x·c(NO2-)y,其中k为速率常数,在一定温度下,进行下列实验:
实验序号 | c(NH4+)/mol·L-1 | c(NO2-)/mol·L-1 | ν/ mol·L-1·s-1 |
1 | 0.0100 | 0.200 | 5.4×10-7 |
2 | 0.0200 | 0.200 | 1.08×10-6 |
3 | 0.200 | 0.040 | 2.16×10-6 |
4 | 0.200 | 0.060 | 3.24×10-6 |
据表知,将溶液稀释至原体积的2倍,反应速度将变为原来的 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修55:有机化学基础]聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类
高分子材料,在材枓的生物相容性方面有很好的应用前景。PPG的一种合成路线如下:
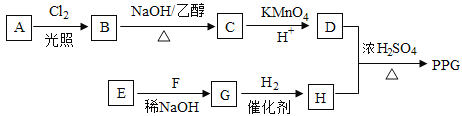
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④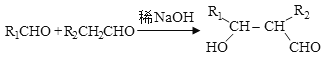 。
。
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)①由D和H生成PPG的化学方程式为 。
②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号)。
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是(写结构简式) :
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种前四周期的元素。A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态。C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8。E位于周期表第12纵列且是六种元素中原子序数最大的。R是由D、E形成的化合物,其晶胞结构如图所示。请回答下列问题:

(1)C元素的电负性___D元素的电负性(填“>”、“<”或“=”)。
(2)C的第一电离能比它同周期前一族相邻元素的第一电离能________
(填“大”或“小”)。
(3)E的价电子排布式为_______ _,该元素位于周期表中__ _族。
(4)化合物A2D的电子式为______________________。
(5)D和B形成的一种化合物D2B2广泛用于橡胶工业,它的分子结构与双氧水相似,但在该化合物分子中,所有原子最外层均满足8电子稳定结构。则D2B2分子中D原子的杂化类型是__________,D2B2是_________分子(填“极性”或“非极性”)。
(6)R的化学式为________________(用元素符号表示)。已知R晶体的密度为ρ g·cm-3,则该晶胞的边长a=_____________ cm,(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料分为甲醇汽油和甲醇柴油,工业合成甲醇的方法很多。
(1)一定条件下发生反应:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
2CO(g)+O2(g)═2CO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则CO(g)+2H2(g)CH3OH(g)的△H═ _________.
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图1所示,该反应的△H____0 (填>、<或=).
(3)若要提高甲醇的产率,可采取的措施有(填字母)___________
A.缩小容器体积
B.降低温度
C.升高温度
D.使用合适的催化剂
E.将甲醇从混合体系中分离出来

(4)CH4和H2O在催化剂表面发生反应CH4+H2OCO+3H2,T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,计算该温度下上述反应的化学平衡常数_____________________(结果保留小数点后两位数字)
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图2是目前研究较多的一类固体氧化物燃料电池工作原理示意图,B极的电极反应式为_________
(6)25℃时,草酸钙的Ksp=4.0×10﹣8,碳酸钙的Ksp=2.5×10﹣9。向10ml碳酸钙的饱和溶液中逐滴加入8.0×10﹣4molL﹣1的草酸钾溶液10ml,能否产生沉淀__________(填“能”或“否”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是( )
A.x=1
B.B的转化率为80%
C.2min内A的平均反应速率为0.3 mol·(L·min)-1
D.若混合气体的密度不变,也不能明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为___________;
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g)![]() H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________ kJ。
H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________ kJ。
(4)Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:

①根据上述实验结果,该反应的平衡常数K的计算式为:___________;
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为___________(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=___________min-1.
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为___________(填字母).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com