
����Ŀ�������������ҹ���������������������Ⱥ�����߶ȹ��У�һ����Ϊϸ�������PM2.5��ֱָ��С�ڻ����2.5�Ŀ������ָ������������������ء����ͬʱ���⻯ѧ����Ҳ��ʼ̧ͷ�������ɷǼ�������NOx���ŷ�����ģ�����ʱ��������ֲ�ɫ����������һ������Ⱦ��������Ũ�������ǹ⻯ѧ�����γ��ı�־����ش�����������⣺
��1��������������ϸ������ָ��������� ������ţ���
a��ȼúȡů b�����ͽ�ͨ�豸 c��������ˮ d����ɽ�緢 e���ֲ�ս�� f���ɿ�ҵ
��2����ͼ��ij�ع⻯ѧ�������ձ仯��������ͼ��ʾ��
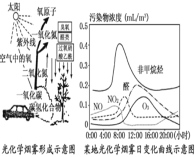
����8:00���Ǽ�������NO���ַ�ֵ�� ���NO2Լ��10:00���ֵ������Ҫ��Ӧ�ķ���ʽ����Ϊ ��8:00��O3��ʼ���ۣ�����13:00���ֵ��O3���������й����й��� O��O2 ��O3���÷�Ӧ�����������ԭ����Ҫ���ɷ�Ӧ�� �����ġ�O3��ʹ10:00ǰNO2�������������ӣ��仯ѧ����ʽΪ ������Ϊ�õع⻯ѧ������������ʱ�������Ϊ ������ţ���
a��8:00 b��10:00 c��15:00 d��20:00
��3����25����101kPa�£������Ħ�����Ϊ24.5L/mol�����������������г���һ����N2O4����NO2 ��N2O4��ƽ�������ܶ�Ϊ3.18 g/Lʱ����������ƽ��Ħ������Ϊ ��N2O4�ķֽ�������ת���ʣ�Ϊ ������������������λ��Ч���֣���
��4��NO��NO2��NH4+��NO2-������Ϊ���Ե����ʣ������ŷŻ��������⡣NH4+��NO2-�ɷ������з�Ӧ��NH4+(aq)��NO2-(aq) ![]() N2(g)��2H2O(l)�ɼӿ�÷�Ӧ�Ĵ�ʩΪ ���÷�Ӧ�ķ�Ӧ���ʷ���Ϊ�� = k��c(NH4+)x��c(NO2-)y������kΪ���ʳ�������һ���¶��£���������ʵ����
N2(g)��2H2O(l)�ɼӿ�÷�Ӧ�Ĵ�ʩΪ ���÷�Ӧ�ķ�Ӧ���ʷ���Ϊ�� = k��c(NH4+)x��c(NO2-)y������kΪ���ʳ�������һ���¶��£���������ʵ����
ʵ����� | c(NH4+)/mol��L-1 | c(NO2-)/mol��L-1 | ��/ mol��L-1��s-1 |
1 | 0.0100 | 0.200 | 5.4��10-7 |
2 | 0.0200 | 0.200 | 1.08��10-6 |
3 | 0.200 | 0.040 | 2.16��10-6 |
4 | 0.200 | 0.060 | 3.24��10-6 |
�ݱ�֪������Һϡ����ԭ�����2������Ӧ�ٶ�����Ϊԭ���� ��
���𰸡���1��abdef ��
��2��2NO+O2=2NO2��NO2=NO+O��O3+NO=NO2+O2 ��c��
��3��77.9g/mol ��18.1����
��4�����¡�����Ӧ��Ũ����1/4��
��������
�����������1������ϸ������ָ���ߣ�Ҳ�����ܲ���С������������ˮ���ܲ���С���������abdef����ȷ�ģ�
��2����10��00�㣬NO2Ũ�ȴﵽ���NO��Ũ����С������NO�����ױ���������������2NO��O2=2NO2������������ԭ�ӣ�Ӧ��NO2�ķֽⷴӦ��NO2=NO��O��NO2�������ӣ�O3Ũ�ȴ�ʱ���٣�˵��O3���뷴Ӧ��O3+NO=NO2+O2 ��������ϢO3Ũ�������ǹܻ�ѧ�����γɵı�־������ͼ���������ص�ʱ��Ӧ��14��00���ң���ѡ��c��ȷ��
��3������M=24.5��=24.5��3.18g/mol=77.9g/mol��N2O4![]() 2NO2���迪ʼʱͶ��2molN2O4���ӦxmolN2O4��������2xmolNO2������ƽ��Ħ�������Ķ��壺77.9=2��92/(2��x��2x)�����x=0.362����ת����Ϊ0.362/2��100%=18.1%��
2NO2���迪ʼʱͶ��2molN2O4���ӦxmolN2O4��������2xmolNO2������ƽ��Ħ�������Ķ��壺77.9=2��92/(2��x��2x)�����x=0.362����ת����Ϊ0.362/2��100%=18.1%��
��4���ӿ췴Ӧ���ʿ��������¶ȡ�����Ũ�ȡ�ʹ�ô����ȣ�ʵ��1��2�����ݴ��빫ʽ������ó���x=1����ʵ��3��4�����ݴ��빫ʽ�������y=1����ʵ��1����Ϊ������������Һ�����Ϊ1L��ϡ��Ϊԭ����2������Ũ�ȷֱ�Ϊ0.01/2mol��L��1��0.2/2mol��L��1�����빫ʽ����Ӧ���ʱ�Ϊԭ����1/4.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij̽��С���������ͼ��ʾװ��(�г֡�����������)��ģ�ҵ���������Ʊ�������ȩ(CCl3CHO)��ʵ�顣�������ϣ��й���Ϣ���£�


��1������A�з�����Ӧ�Ļ�ѧ����ʽ��______��װ��B�е��Լ���_______��
��2������ȥװ��C�����ܵ���װ��D�и�����_____(�ѧʽ)�������ӣ�װ��D�ɲ��� ���ȵķ����Կ��Ʒ�Ӧ�¶���70�����ҡ�
��3����Ӧ��������������Ƚ�D�еĻ������ȴ�����£����ù��˵ķ��������CCl3COOH������Ϊ�˷����Ƿ���У�Ϊʲô?_______________��
��4��װ��E�п��ܷ���������Ӧ�����ӷ���ʽ��_________________��
��5���ⶨ��Ʒ���ȣ���ȡ��Ʒ0��30 g��ɴ�����Һ������0��1000 mol��L-1�����Һ20��00 mL���ټ�������Na2CO3��Һ����Ӧ��ȫ�����������Һ��pH��������0��02000 mo1��L-1Na2S2O3��Һ�ζ����յ㡣����ƽ��ʵ��������Na2S2O3��Һ20��00 mL�����Ʒ�Ĵ���Ϊ_________��(CCl3CHO����Է�������Ϊ147��5)�ζ��ķ�Ӧԭ����CCl3CHO+OH��==CHCl3+HCOO����HCOO��+I2==H++2I��+CO2�� ��I2+2S2O32-==2I-+S4O62-
��6����֪��������Ka(CCl3COOH)=1.0��10-1mol��L-1��Ka (CH3COOH)= 1.7��10-5mol��L-1�������ʵ��֤���������ᡢ���������ǿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
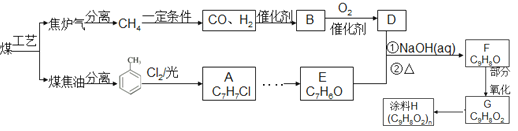
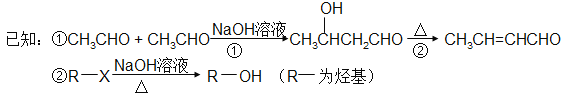
����Ŀ����úΪԭ�Ͽɺϳ�Ϳ��H(����ͼ)��B����ʽΪC2H6O�������Ʒ�Ӧ�ų���������ע��������ijЩ��Ӧ����û�и�������
��ش�
��1��������ú���ۺ����õĹ�������Ϊ ��
��2��B�Ľṹ��ʽ�� ��E�к��������ŵ������� ��
��3��G��H��Ӧ�Ļ�ѧ����ʽ ��
��4�����ڻ�����F,����˵����ȷ���� ��
A���ܷ���������Ӧ B����ʹBr2��CCl4��Һ��ɫ
C���ܷ���ˮ�ⷴӦ D����������Ʒ�Ӧ
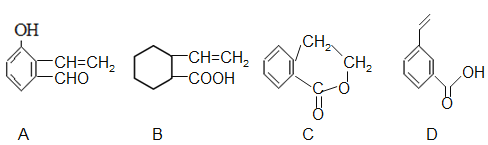
��5�������л�����G���ǻ�Ϊͬ���칹����� ��
��6���� ��E �ĺϳ�·�ߣ��Լ����ܼ���ѡ���ϳ�·�߲��ա���֪�١�����д��ʽ�� ��
��E �ĺϳ�·�ߣ��Լ����ܼ���ѡ���ϳ�·�߲��ա���֪�١�����д��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����κ����ʳƷ��ҽҩ�ȷ������Ź㷺��;��һ�ֺϳɰ�κ��ķ�Ӧ�ɱ�ʾΪ

����˵����ȷ����
A. ��������KMnO4��Һ���������Ӧ�Ƿ��а�κ������
B. �����ء���κ�������Na2CO3��NaOH��Һ��Ӧ
C. ͨ�������£������ء���κ�ᶼ�ܷ���ȡ�����ӳɡ���ȥ��Ӧ
D. �������ػ�Ϊͬ���칹�壬��������4�ֲ�ͬ��ѧ�������⣬���ܷ���������Ӧ�ķ�����ﹲ��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(VB2)��������ع���ʱ��ӦΪ��4VB2 + 11O2 = 4B2O3 + 2V2O5���øõ��Ϊ��Դ��ѡ�ö��Ե缫�������ͭ��Һ��ʵ��װ����ͼ��ʾ�������·��ͨ��0.04mol����ʱ��Bװ���ڹ��ռ���0.448L����(��״��)��������˵����ȷ����
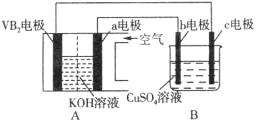
A��VB2�缫�����ĵ缫��ӦΪ��2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+
B�����·�е�����c�缫����VB2�缫
C���������У�c�缫�������к�ɫ�����������������ݲ���
D����Bװ���ڵ�Һ�����Ϊ100 mL����CuSO4��Һ�����ʵ���Ũ��Ϊ0.05 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ�����һ��ʳ�����ϣ���ṹ��ʽ��ͼ��ʾ�����ڸ��л����������������ȷ����

�ٷ���ʽΪC12H20O2
����ʹ����KMnO4��Һ��ɫ
���ܷ����ӳɷ�Ӧ�������ܷ���ȡ����Ӧ
������ͬ���칹���п����з����廯��������ڷ����廯�����ͬ���칹����8��
��1mol���л���ˮ��ʱֻ������1molNaOH
��1mol���л�����һ�������º�H2��Ӧ��������H2Ϊ3mol
A���٢ڢ� B���٢ڢ� C���٢ڢݢ� D���٢ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�ˮ�����ӳ���KW��10��13�������¶���pH��11��Ba(OH)2��ҺaL��pH��1��H2SO4��ҺbL��ϣ�������Һ���Ϊ����֮�ͣ����ù���������Բ��ơ�
��1�������û����ҺΪ���ԣ���a:b��________�����ɳ������ʵ���Ϊ______mol(�ú�b����ʽ����ʾ)��
��2����a:b��9:2����������ҺpH��_____���û����Һ������ܽ�����_______g(�ú�a��b����ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaNO2����һ�ֳ�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ������������ij��ȤС���������ʵ��̽������������֪������2NO+Na2O2=2NaNO2 ��2NO2+Na2O2=2NaNO3������KMnO4��Һ�ɽ�NO2������ΪNO3����MnO4����ԭ��Mn2+��
��Ʒ�Ʊ�����飺����ͼ1װ���Ʊ�NaNO2��
��1��д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ__________
��2��Bװ�õ�������_______
��3����ͬѧ��Ϊװ��C�в��ﲻ�����������ƣ����������ơ�̼���ơ��������ƣ�Ϊ�Ʊ�����NaNO2Ӧ��B��Cװ�ü�����һ��װ�ã������ҿ��ڻ������ӵ�װ��ͼ2��������ʢ�ŵ��Լ���
��4�������ʵ�����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ�_____________________
�����IJⶨ
��ȡװ��C�з�Ӧ��Ĺ���4.00g����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
![]()
��5����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������________��˫��ѡ��
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
B����ƿϴ����δ����
C���ζ��������Ӷ���
D���ζ��������Ӷ���
��6�����ݱ������ݣ��������ù������������Ƶ���������________���������4λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO4��7H2O��������ȱ����ƶѪҩƷ����Ҫ�ɷ֡���������������м��������������������������Ϊԭ�����������̷���һ�ַ�����
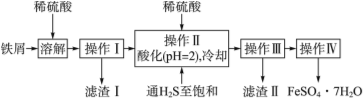
��ѯ���ϣ����й����ʵ�������������
25 ��ʱ | pH[] |
����H2S��Һ | 3.9 |
SnS������ȫ | 1.6 |
FeS��ʼ���� | 3.0 |
FeS������ȫ | 5.5 |
��1���������У�ͨ�����������͵�Ŀ����_______������Һ���������ữ��pH��2��Ŀ����________��
��2�����������Ҫ�ɷ���__________��
��3���������õ����̷�������������ˮϴ�ӣ���Ŀ���ǣ�
�ٳ�ȥ������渽�ŵ���������ʣ���_____________________________��
��4���ⶨ�̷���Ʒ��Fe2�������ķ����ǣ�a����ȡ2.850 g�̷���Ʒ���ܽ⣬��250 mL����ƿ�ж��ݣ�b����ȡ25.00 mL������Һ����ƿ�У�c���������ữ��0.010 00 mol��L��1 KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00 mL��
�ٵζ�ʱʢ��KMnO4��Һ������Ϊ__________����������������
���жϴ˵ζ�ʵ��ﵽ�յ�ķ�����____________________________��
�ۼ���������Ʒ��FeSO4��7H2O����������Ϊ____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com