
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO?B2O3?H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:
已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、5.2、9.7和12.4。
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器溢出,故应分批加入稀硫酸。该反应的化学方程式为 。
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO42-,还含有Fe3 +、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是 。H2O2的作用是 (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是 。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4?H2O,应采取的措施是将“母液”蒸发浓缩, 。
32.(16分)
(1)CaCO3(粉末)+H2SO4=CaSO4+H2O+CO2↑ (3分)
(2)Fe3+、Fe2+、Al3+ (3分,每个1分)
H2O2+2H++2Fe2+=2Fe3++2H2O (3分)
(3)防止温度下降时H3BO3从溶液中析出(意思相同即可给分。例如:从H3BO3溶解度数据可知,温度较高时,H3BO3溶解度较大,不易从溶液中析出。) (3分)
(4)加压升温结晶 (4分,加压、升温结晶各2分)
解析试题分析:(1)由于硫酸的酸性比碳酸强,则矿粉中的碳酸钙与加入的稀硫酸能发生复分解反应,生成硫酸钙、二氧化碳气体和水,即CaCO3(粉末)+H2SO4=CaSO4+H2O+CO2↑,粉末状碳酸钙及分批加入稀硫酸能加快反应速率、防止微溶的硫酸钙覆盖在碳酸钙固体表面阻止反应的顺利进行;根据流程图及题意可知,浸取时2MgO?B2O3?H2O及少量Fe3O4、CaCO3、Al2O3都能溶于稀硫酸,而SiO2不能溶于稀硫酸;(2)双氧水是常用的绿色氧化剂,所含氧元素由—1价降低为—2价,杂质阳离子中只有亚铁离子能被其氧化为铁离子,即H2O2+2H++2Fe2+=2Fe3++2H2O;由于铁离子和铝离子能够水解,即Fe3++3H2O Fe(OH)3+3H+、Al3++3H2O
Fe(OH)3+3H+、Al3++3H2O Al(OH)3+3H+,用稀硫酸浸取及浸出液呈酸性时,能抑制铁离子和铝离子的水解,加入过氧化氢和氧化镁时,能消耗氢离子、生成水且不引入新的杂质阳离子,即MgO+2H+=Mg2++H2O,减小氢离子浓度,增大溶液pH至3.2时,促进铁离子水解到底,即亚铁离子转化为铁离子,铁离子完全沉淀为氢氧化铁,增大溶液pH至5.2时,促进铝离子水街到底,即铝离子完全沉淀为氢氧化铝沉淀,因此加入适量过氧化氢和氧化镁除去的杂质离子是Fe3+、Fe2+、Al3+;(3)浸取时二氧化硅不溶于稀硫酸,浸取反应生成硫酸钙微溶于水,其余物质溶解后变为硼酸、硫酸亚铁、硫酸铁、硫酸镁,根据已知信息,H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g,为了除去固液混合物中的二氧化硅和硫酸钙,且不能损失硼酸,因此应选择硼酸溶解度最大时的温度,进行趁热过滤,防止温度下降时H3BO3从溶液中析出;(4)除杂时,所得滤渣的主要成分是氢氧化铁、氢氧化铝,而母液的主要成分是硼酸、硫酸镁;为了从“母液”中充分回收MgSO4?H2O,根据硫酸镁的溶解度随温度变化的曲线的已知信息推断,若蒸发浓缩、冷却结晶得到的是MgSO4?7H2O晶体,因此应该蒸发浓缩,升温结晶;根据溶液的沸点随压强增大而升高的已知条件,为了防止蒸发时液体沸腾,影响结晶,还要加压结晶,防止蒸发浓缩时溶液沸腾,从而得到MgSO4?H2O晶体。
Al(OH)3+3H+,用稀硫酸浸取及浸出液呈酸性时,能抑制铁离子和铝离子的水解,加入过氧化氢和氧化镁时,能消耗氢离子、生成水且不引入新的杂质阳离子,即MgO+2H+=Mg2++H2O,减小氢离子浓度,增大溶液pH至3.2时,促进铁离子水解到底,即亚铁离子转化为铁离子,铁离子完全沉淀为氢氧化铁,增大溶液pH至5.2时,促进铝离子水街到底,即铝离子完全沉淀为氢氧化铝沉淀,因此加入适量过氧化氢和氧化镁除去的杂质离子是Fe3+、Fe2+、Al3+;(3)浸取时二氧化硅不溶于稀硫酸,浸取反应生成硫酸钙微溶于水,其余物质溶解后变为硼酸、硫酸亚铁、硫酸铁、硫酸镁,根据已知信息,H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g,为了除去固液混合物中的二氧化硅和硫酸钙,且不能损失硼酸,因此应选择硼酸溶解度最大时的温度,进行趁热过滤,防止温度下降时H3BO3从溶液中析出;(4)除杂时,所得滤渣的主要成分是氢氧化铁、氢氧化铝,而母液的主要成分是硼酸、硫酸镁;为了从“母液”中充分回收MgSO4?H2O,根据硫酸镁的溶解度随温度变化的曲线的已知信息推断,若蒸发浓缩、冷却结晶得到的是MgSO4?7H2O晶体,因此应该蒸发浓缩,升温结晶;根据溶液的沸点随压强增大而升高的已知条件,为了防止蒸发时液体沸腾,影响结晶,还要加压结晶,防止蒸发浓缩时溶液沸腾,从而得到MgSO4?H2O晶体。
考点:考查物质制备化学工艺流程,涉及硫酸和碳酸的酸性、复分解反应、化学方程式、混合物分离与提纯的除杂试剂及原理、根据硼酸的溶解度信息解释热过滤的原因、根据溶解度曲线及压强对溶液沸点的影响选择制备结晶水化合物的措施等。


科目:高中化学 来源: 题型:填空题
【化学选修-化学与技术】(15分)
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
⑴反应器中加入的酸应选用___________________。
⑵脱色槽中应加入的物质X是_______________;设备A的作用是______________;设备B的名称为________________;设备C的作用是____________________。
⑶为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是____________ _。反应的化学方程式为_________________。
| A.水 | B.浓硫酸 | C.石灰乳 | D.硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)Ⅰ.“中东有石油,中国有稀土”。稀土金属是我国战略性资源,应加以保护。稀土金属是周期表中ⅢB族中钪、钇和镧系十七种元素的总称,都是很活泼的金属,性质极为相似,常见化合价为+3价。钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色” 消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备C1O2的流程如下:
(1)C1O2中所有原子________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用________
A.饱和食盐水B.碱石灰 C.浓硫酸D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是________(填选项字母)。
A.二氧化氯可广泛用于工业和饮用水处理
B.二氧化氯应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和检测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,化学方程式为________。此法缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式为________此法相比欧洲方法的优点是________。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学方程式为________。此法提高了生产及储存、运输的安全性,原因是_________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2Fe04)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下: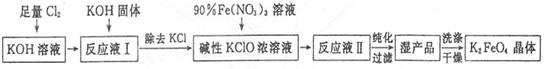
已知:2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)将Cl2通入KOH溶液中发生反应的离子方程式是____________。
(2)写出工业上制取Cl2的化学方程式____________。
(3)在“反应液I”中加入KOH固体的目的是____________。
(4)K2FeO4可作为新型多功能水处理剂的原因是____________。
(5)配制KOH溶液时,将61.6g KOH固体溶解在100 mL水中,所得溶液的密度为1.47 g ? mL-1,则该溶液的物质的量浓度为____________。
(6)从“反应液II”中分离出K2Fe04后,副产品是___________ (写化 学 式)。
(7)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下:
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
(2)氧化时控制反应液温度为55~60℃的原因是 。
(3)若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为 。
(4)生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
CaCO3是一种化工原料,可以通过反应生成一系列物质,如下图所示。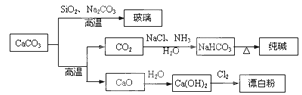
下列说法正确的是
| A.Cl2和SO2均可以漂白有色物质,且漂白的原理相同 |
B.由SiO2+Na2CO3 Na2SiO3+CO2↑可知,H2CO3的酸性强于H2SiO3 Na2SiO3+CO2↑可知,H2CO3的酸性强于H2SiO3 |
| C.工业上,可先向饱和食盐水中通入NH3后,再通入CO2制NaHCO3 |
| D.制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某地农田土壤胶体的胶粒带负电荷,若在该农田里施加含氮量相等的下列化肥,有效成分利用率最差的是( )
| A.(NH4)2SO4 | B.NH4HCO3 | C.NH4NO3 | D.NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
合成氨时既要使氨的产率增大,又要使反应速率加快,可采取的办法是( )。
①减压 ②加压 ③升温 ④降温⑤及时从平衡混合气中分离出NH3
⑥补充N2或H2 ⑦加催化剂 ⑧减小N2或H2的量
| A.③④⑤⑦ | B.①②⑤⑥ | C.②⑥ | D.②③⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com