
| A. | ${\;}_{40}^{95}$Zr和${\;}_{40}^{92}$Zr两原子的核外电子总数相等 | |
| B. | ${\;}_{40}^{95}$Zr的中子数和电子数之差为55 | |
| C. | ${\;}_{40}^{95}$Zr和${\;}_{40}^{92}$Zr是同种核素 | |
| D. | ${\;}_{40}^{95}$Zr属于非金属元素 |
分析 根据原子符号左上角的数字表示质量数,左下角的数字表示质子数,核外电子数=质子数、中子数=质量数-质子数;同种核素是质子数相同,中子数相同的原子.
解答 解:A.${\;}_{40}^{95}$Zr和${\;}_{40}^{92}$Zr的质子数都为40,所以核外电子数都为40,核外电子总数相同,故A正确;
B.${\;}_{40}^{95}$Zr的质子数为40,核外电子数为40,质量数为95,中子数为95-40=55,中子数和电子数之差15,故B错误;
C.${\;}_{40}^{95}$Zr和${\;}_{40}^{92}$Zr是质子数相等,中子数不同,不是同种核素,故C错误;
D.两原子的质子数都为40,所以核外电子数都为40,核外电子总数相同,${\;}_{40}^{95}$Zr是锆元素的一种原子,属于金属元素,故D错误;
故选A.
点评 本题主要考查了同种核素,原子符号的含义以及各微粒数目之间的关系,难度不大.


科目:高中化学 来源: 题型:推断题
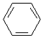 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
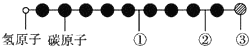 据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )
据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )| A. | ①处的化学键表示碳碳双键 | B. | 此星际分子属于烷烃 | ||
| C. | ②处的化学键表示碳碳单键 | D. | ③处的原子可能是氯原子或氟原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的化学性质稳定,常温下不与任何物质反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅元素在地壳中的含量居第一位 | |
| C. | 硅在自然界中可以以游离态存在 | |
| D. | 高纯度的单质硅被广泛用于制作计算机芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
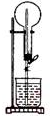 如图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体.挤压滴管的胶头,下列与实验事实不相符的是( )
如图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体.挤压滴管的胶头,下列与实验事实不相符的是( )| A. | CO2(NaOH溶液)/无色喷泉 | B. | NH3(H2O含石蕊)/红色喷泉 | ||
| C. | H2S(CuSO4溶液)/黑色喷泉 | D. | HCl(AgNO3溶液)/白色喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol/(L•s) | B. | 2mol/(L•s) | C. | 1.5 mol/(L•s) | D. | 0.5mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com