
【题目】(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g)。该可逆反应达到平衡的标志是________。
2NH3(g)。该可逆反应达到平衡的标志是________。
A.3v正(H2)=2v逆(NH3) B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min | CH4/mol | H2O/mol | CO/mol | H2/mol |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
分析表中数据,判断5 min时反应是否处于平衡状态?______(填“是”或“否”),前5 min反应的平均反应速率v(CH4)=____________________。
(3)恒温恒容下,将2 mol 气体A和2 mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min后反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
①x=________。
②A的转化率与B的转化率之比为________。
【答案】C 是 0.02 mol·L-1·min-1 3 2:1
【解析】
(1)根据平衡状态的特征分析;
(2)根据平衡时物质的浓度不再发生变化分析;根据反应速率=△c/△t计算;
(3)根据三段式计算。
(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。则
A.3v正(H2)=2v逆(NH3)不满足正逆反应速率相等,没有达到平衡状态,A不选;
B.单位时间生成m mol N2的同时生成3m mol H2均是逆反应速率,不能说明反应达到平衡状态,B不选;
C.正反应体积减小,容器内的总压强不再随时间而变化能说明反应达到平衡状态,C选;
D.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此混合气体的密度不再随时间变化不能说明反应达到平衡状态,D不选;
答案选C。
(2)根据方程式CH4+H2O=CO+3H2结合表中数据可知c=0.2,所以5 min时反应已经处于平衡状态;前5 min内消耗甲烷是0.2mol,浓度是0.1mol/L,则反应的平均反应速率v(CH4)=0.1mol/L÷5min=0.02 mol·L-1·min-1。
(3) 2A(g)+B(g)![]() xC(g)+2D(s)
xC(g)+2D(s)
起始量(mol) 2 2 0
转化量(mol) 1.6 0.8 0.8x
平衡量(mol) 0.4 1.2 0.8x
①C的浓度为1.2 mol/L,则1.2×2=0.8x,解得x=3。
②A的转化率与B的转化率之比为![]() 。
。


科目:高中化学 来源: 题型:
【题目】酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂,用所学知识回答问题:
(1)3H2SO4+2KMnO4+5H2O2===K2SO4+2MnSO4+5O2↑+8H2O,当有6 mol H2SO4参加反应,有________mol还原剂被氧化。
(2)在稀硫酸中,KMnO4与H2C2O4反应的离子方程式为__________________________
(3)Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,再变为棕黄色,溶液先变为浅绿色的离子方程式是_______________ ,再变为棕黄色的原因是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图回答下列问题:
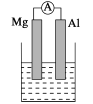
Ⅰ.(1)若烧杯中溶液为稀硫酸,则观察到的现象是__________,负极反应式为:_______________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为________________________________。
Ⅱ. (3)由Al、Cu、浓硝酸组成原电池,其负极的电极反应式为______________________。
Ⅲ.中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇(CH3OH)燃料电池的工作原理如下图所示。
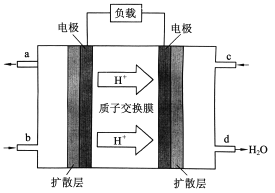
(4)该电池工作时,b口通入的物质为_______,c口通入的物质为______。
(5)该电池正极的电极反应式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是

A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 氢氧化钡溶液与足量硫酸氢钠的溶液混合:Ba2++OH―+H++SO42―=BaSO4↓+H2O
B. 过量的铁溶于稀硝酸:Fe+4H++NO3―=Fe3++NO↑+2H2O
C. 氯气与水:Cl2+H2O![]() 2H++Cl―+ClO―
2H++Cl―+ClO―
D. 硫酸铝溶液中加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ca(OH)2和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42—(aq)+ Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)。
CaWO4(s)+2OH-(aq)。
(1)如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。

①计算T1时Ksp(CaWO4)=________。
②T1________T2(填“>”、“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如表所示:
温度/℃ | 25 | 50 | 90 | 100 |
K | 79.96 | 208.06 | 222.88 | 258.05 |
①该反应平衡常数K的表达式为________________。
②该反应的ΔH________0(填“>”、“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42—的沉淀率为60%,计算实验测得的平衡常数________________。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析作用: __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
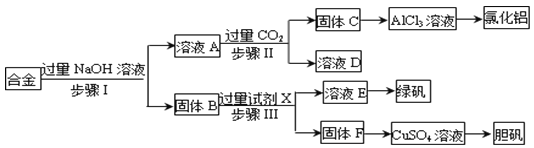
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ反应的离子方程式:_________________________。
(2)试剂X是______。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是________。
(3)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式_______________________________,请选出你认为的最佳途径并说明选择的理由______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关项目的比较中,错误的是
A.酸性:H2SiO3>H2CO3B.氧化性:Fe3+>Fe2+
C.热稳定性:Na2CO3>NaHCO3D.硬度:金刚石>刚玉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,化学键类型相同、晶体类型也相同的是
A. SO2和SiO2 B. CO2和H2S C. NaCl和HCl D. CCl4和KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com