
【题目】下列有关项目的比较中,错误的是
A.酸性:H2SiO3>H2CO3B.氧化性:Fe3+>Fe2+
C.热稳定性:Na2CO3>NaHCO3D.硬度:金刚石>刚玉
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一种微生物电池可进行多种污水净化和海水淡化的综合处理,该电池装置的示意图如图所示,其中污
水中的有机物用C6H10O5表示,海水用食盐水代替。下列说法正确的是

A. b膜为阴离子交换膜
B. 处理后的含NO3-污水的pH降低
C. 负极反应式为C6H10O5+7H2O+24e-==6CO2↑+24H+
D. 导线中流过lmol电子,理论上有1molCl-通过a膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g)。该可逆反应达到平衡的标志是________。
2NH3(g)。该可逆反应达到平衡的标志是________。
A.3v正(H2)=2v逆(NH3) B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min | CH4/mol | H2O/mol | CO/mol | H2/mol |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
分析表中数据,判断5 min时反应是否处于平衡状态?______(填“是”或“否”),前5 min反应的平均反应速率v(CH4)=____________________。
(3)恒温恒容下,将2 mol 气体A和2 mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min后反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
①x=________。
②A的转化率与B的转化率之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液与氨水反应:Al3++3OH-![]() Al(OH)3↓
Al(OH)3↓
B. 氧化镁与稀盐酸反应:MgO+2H+![]() Mg2++H2O
Mg2++H2O
C. 铜与氯化铁溶液反应:2Fe3++3Cu![]() 2Fe+3Cu2+
2Fe+3Cu2+
D. 稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+![]() BaSO4↓
BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国NASA曾开发一种铁—空气二次电池。该电池放电时,其原理如下图所示,电池反应为:2Fe+O2+2H2O===2Fe(OH)2。
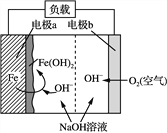
有关该电池放电时的说法正确的是( )
A. a极质量不变
B. b极为电池负极
C. 电子由a极经负载流向b极
D. 由电能转变为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
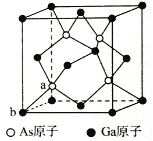
【题目】N、P、As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
(1)意大利罗马大学的Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为______________________,N—N键的键角为______________________;
(2)基态砷原子的价电子排布图为______________________,砷与同周期相邻元素的第一电离能由大到小的顺序为______________________;
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是____________________(填“PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是____________________;S—Cl键键长 ______P-Cl键键长(填“>”、“=”或“<”),原因是____________________。
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为____________________。若该晶体的密度为ρg/cm3,设NA为阿伏加德罗常数的值,则a、b的距离为_________pm(用含ρ和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式如下:
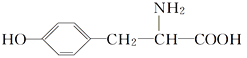
(1)酪氨酸能发生的化学反应类型有________(填字母)。
A.取代反应 B.氧化反应
C.酯化反应 D.中和反应
(2)在酪氨酸的同分异构体中,同时满足如下三个条件的,除酪氨酸外还有________种。
①属于氨基酸且“碳骨架”与酪氨酸相同;②与氯化铁溶液能发生显色反应;③氨基(—NH2)不与苯环直接相连。
(3)已知氨基酸能与碱反应,写出酪氨酸与足量的NaOH溶液反应的化学方程式:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com