
| A、强电解质溶液的导电能力一定强于弱电解质溶液 |
| B、乙酸溶液中存在的微粒有CH3COOH、CH3COO-、H+、OH-、H2O |
| C、0.05mol的NaOH固体分别加入到体积都是100ml的自来水、0.5mol/L的乙酸、0.5mol/L的盐酸和0.5mol/L的NaCl溶液中,溶液导电能力变化最小的是自来水 |
| D、在相同温度下,a强电解质,b弱电解质,c金属Al的导电能力相同,升高温度后它们的导电能力都增强 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、△H>0,m+n>x |
| B、△H<0,m+n>x |
| C、△H>0,m+n<x |
| D、△H<0,m+n<x |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③④ |
| C、②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体与溶液的分离可采用过滤的方法 |
| B、胶体与溶液的本质区别是有丁达尔效应 |
| C、将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 |
| D、胶体属于介稳体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
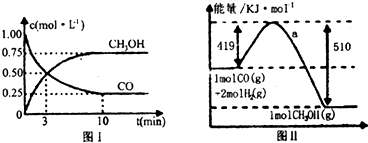
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、2CN-+H2O+CO2→2HCN+CO32- |
| B、2HCOOH+CO32-→2HCOO-+H2O+CO2↑ |
| C、中和等体积、等c(H+)的HCOOH和HCN消耗NaOH的量前者小于后者 |
| D、相同物质量浓度的HCOONa和NaCN溶液中:c(HCOO-)<c(CN-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工作时,电解质溶液的pH逐渐增大 |
| B、工作时,能见到浅蓝色火焰 |
| C、工作时,H2为正极,O2为负极 |
| D、电极反应式为:负极:2H2+4OH--4e-=4H2O正极:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
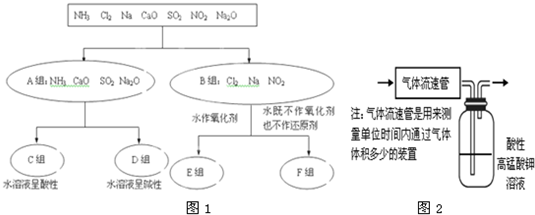
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com