
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、2CN-+H2O+CO2→2HCN+CO32- |
| B、2HCOOH+CO32-→2HCOO-+H2O+CO2↑ |
| C、中和等体积、等c(H+)的HCOOH和HCN消耗NaOH的量前者小于后者 |
| D、相同物质量浓度的HCOONa和NaCN溶液中:c(HCOO-)<c(CN-) |


科目:高中化学 来源: 题型:
| A、Ba(OH)2+H2SO4═BaSO4+2 H2O |
| B、2NaOH+CO2═Na2CO3+H2O |
| C、HCl+NaOH═NaCl+H2O |
| D、2HCl+Na2CO3═2NaCl+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
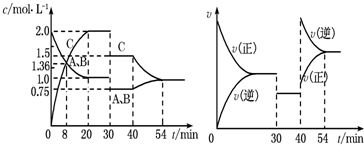
| A、30 min~40 min间该反应使用了催化剂 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30 min时降低温度,40 min时升高温度 |
| D、8 min前A的平均反应速率为0.08 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液的导电能力一定强于弱电解质溶液 |
| B、乙酸溶液中存在的微粒有CH3COOH、CH3COO-、H+、OH-、H2O |
| C、0.05mol的NaOH固体分别加入到体积都是100ml的自来水、0.5mol/L的乙酸、0.5mol/L的盐酸和0.5mol/L的NaCl溶液中,溶液导电能力变化最小的是自来水 |
| D、在相同温度下,a强电解质,b弱电解质,c金属Al的导电能力相同,升高温度后它们的导电能力都增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 v(NH3)=5v(O2) |
| B、6 v(O2)=5v(H2O) |
| C、4v(NH3)=6 v(H2O) |
| D、v(O2)=4v(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com