
【题目】现有下列物质:①稀硫酸 ②氧化铝固体 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液,按要求填空:
(1)上述物质中属于电解质的物质序号为______ ;
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______;
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______;试用离子方程式说明:_______________、______________;
(4)能导电的物质序号为_______________;
(5)实验室用⑤制备胶体的化学方程式为_______________________。
【答案】②⑤ ①⑥ ② Al2O3+6H+==2Al3++3H2O Al2O3+2OH-==2AlO2-+H2O ③⑥ FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
【解析】
(1)电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
(2)H++OH-=H2O可以表示强酸与可溶性强碱反应生成可溶性盐和水;
(3)两性物质,弱酸的酸式盐,弱酸的铵盐,铝,氨基酸,蛋白质既能与盐酸又能与氢氧化钠反应,酸性环境下硝酸根离子能氧化二价铁离子;
(4)物质导电的条件:存在自由电子,或者存在自由移动的离子;
(5)依据氯化铁水解性质解答;
(1)电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
故答案为:②⑤;
(2)H++OH-=H2O可以表示强酸与可溶性强碱反应生成可溶性盐和水;
故答案为:①⑥;
(3)两性物质,弱酸的酸式盐,弱酸的铵盐,铝,氨基酸,蛋白质既能与盐酸又能与氢氧化钠反应,酸性环境下硝酸根离子能氧化二价铁离子,故给出的物质中既能与盐酸反应又能与氢氧化钠溶液反应是氧化铝,离子方程式是Al2O3+6H+==2Al3++3H2O ;Al2O3+2OH-==2AlO2-+H2O;
故答案为:②;Al2O3+6H+==2Al3++3H2O ;Al2O3+2OH-==2AlO2-+H2O;
(4)物质导电的条件:存在自由电子,或者存在自由移动的离子,
故答案为:③⑥;
(5)实验室向沸水中加入饱和氯化铁溶液来制备氢氧化铁胶体,其化学方程式为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
故答案为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B![]() C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
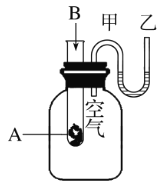
(1)该反应为________(填“放热”或“吸热”)反应。
(2)A和B的总能量比C和D的总能量_______(填“高”或“低”)。
(3)物质中的______能转化成______能释放出来。
(4)反应物化学键断裂吸收的能量__________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】花椒毒素(H)有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A为原料合成H的一种合成路线如下:
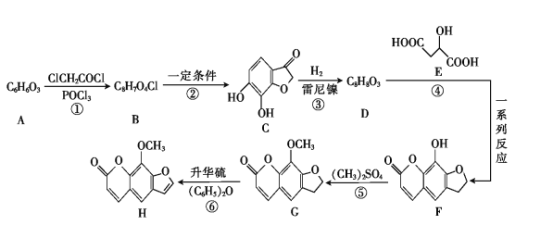
已知:![]() +ClCH2CH2Cl
+ClCH2CH2Cl![]()
![]() +HCl
+HCl
回答下列问题:
(1)A的化学名称是 _____(用系统命名法)。
(2)G中所含官能团的名称是 ____。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中___ (填“有”或“没有”)手性碳。
(4)反应⑥的反应类型是 ____ 。
(5)D的结构简式为 _____。
(6)F与足量NaOH溶液反应的化学方程式为 ____。
(7)芳香族化合物W是D的同分异构体,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应;W的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W有____种。
(8)有机物M(![]() )是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
)是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有__________个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_______(填元素符号),判断理由为_______________。
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于____________。

(3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为______________。
②该化合物难溶于水但易溶于氨水,其原因是_____________ ,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。
③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )
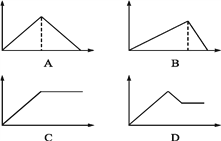
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图图象中,纵坐标为沉淀物的物质的量,横坐标为向溶液中加入反应物的物质的量,则相应的图像序号与(1)—(4)对应的是
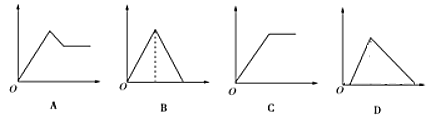
溶液 | 加入物质 | 对应的图像 |
(1)饱和石灰水 | 通过量CO2气体 | ____ |
(2)氯化铝溶液 | 加入过量氨水 | ____ |
(3)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 | ____ |
(4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 | ____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.22.4 L H2O的物质的量为1mol
B.常温常压16 g O2的物质的量为0.5mol
C.标准状况下16 g O2中含有的氧原子数为0.5mol
D.物质的量浓度为0.5 mol·L-1 MgCl2 溶液中,Cl-浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H(![]() )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]()
(1)生成A的反应类型是___________,F中所含官能团的结构简式为______________。
(2)B的结构简式是___________;“B→C”的反应中,除C外,另外一种产物名称是______。
(3)D+G→H的化学方程式是_____________________________________________。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有5组峰,且峰面积比为1:2:2:2:1的结构简式为_____________________。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成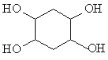 ,写出合成路线______________。(合成路线流程图示例:H2C=CH2
,写出合成路线______________。(合成路线流程图示例:H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5)。
CH3COOC2H5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.1mol/LH2SO4溶液的叙述错误的是
A.1L该溶液中含有H2SO4的质量为9.8g
B.0.5L该溶液中氢离子的物质的量浓度为0.2mol/L
C.从1L该溶液中取出100mL,则取出的溶液中H2SO4的物质的量浓度为0.01mol/L
D.取该溶液10mL加水稀释至100mL后,H2SO4的物质的量浓度为0.01mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com