
分析 ①v=$\frac{△c}{△t}$,在化学反应方程式中,速率之比等于系数之比;
②达到平衡的过程,由于刚开始反应物浓度较大,因此开始反应速率较快,后逐渐减慢;
③改变起始物质加入的量,欲使反应达到平衡时某物质的物质的量分数与原平衡相等,则需达到等效平衡状态.
解答 解:①在1min中用SO3表示的反应速率v(SO3)=$\frac{△c(SO3)}{△t}$=$\frac{0.4mol•L-1}{1min}$=0.4 mol•L-1•min-1,所以v(O2)=0.5×0.4 mol•L-1•min-1=0.2 mol•L-1•min-1
故答案为:0.2 mol•L-1•min-1;
②后一分钟内速率小于前1min的反应速率,故后1min内SO3的浓度变化量小于0.4mol•L-1,故2分钟达到平衡,平衡时SO3的浓度小于0.8mol/L.
故答案为:小于;
③改变起始物质加入的量,欲使反应达到平衡时SO3的物质的量分数与原平衡相等,恒温恒容下,反应前后气体体积不相等,按化学计量数转化到左边满足n(SO2)=2mol,n(O2)=1mol,所以有a+c=2,b+$\frac{c}{2}$=1
故答案为:a+c=2;b+$\frac{c}{2}$=1.
点评 本题综合了化学反应速率以及平衡常数的知识,综合性比较强,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/(L•min) | B. | 1.8 mol/(L•min) | C. | 0.6mol/(L•min) | D. | 2.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
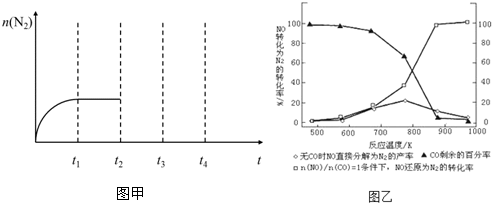
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | ④ | ⑤ | |||||
| 3 | ① | ② | ⑥ | ⑦ | ⑧ | |||
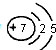 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
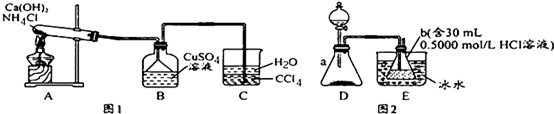
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
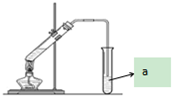 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: ,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;
,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L氯化铜溶液中的Cu2+数小于NA | |
| B. | 标准状况下,22.4 L Cl2与水反应转移的电子数为NA | |
| C. | 28 g聚乙烯含有的碳原子数为2NA | |
| D. | 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com