
【题目】在容积为1.0L的恒容密闭容器中进行可逆反应:![]() 。判断该可逆反应达到平衡状态的依据有( )
。判断该可逆反应达到平衡状态的依据有( )
A.单位时间内消耗X和Y的物质的量之比为1:2
B.容器内气体的压强不再随时间改变
C.容器内气体的密度不再随时间改变
D.气体Z的物质的量不再随时间变化
科目:高中化学 来源: 题型:
【题目】常温下,向20mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
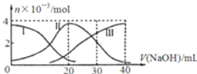
A.滴加过程中当溶液呈中性时,![]()
B.当![]() 时,则有:
时,则有:![]()
C.H![]() 在水中的电离方程式是:H
在水中的电离方程式是:H![]() ;
;![]()
D.当![]() 时,则有:
时,则有:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是
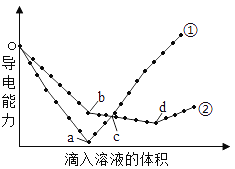
A.b→d反应的离子方程式为:H++OH-=H2O
B.o→a反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.c点导电能力相同,所以两溶液中含有相同量的OH–
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
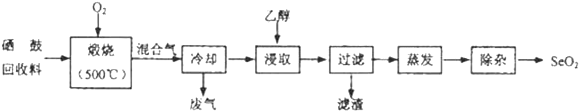
【题目】硒鼓回收料含硒约![]() ,其余为约
,其余为约![]() 的碲和微量的氯.从该回收料中回收硒的工艺流程如图所示
的碲和微量的氯.从该回收料中回收硒的工艺流程如图所示![]() 已知煅烧过程中,回收料中的硒、碲被氧化成
已知煅烧过程中,回收料中的硒、碲被氧化成![]() 和
和![]() :
:
部分物质的物理性质如表:
物质 | 熔点 | 沸点 | 溶解度 |
|
|
| 易溶于水和乙醇 |
|
|
| 微溶于水,不溶于乙醇 |
回答下列问题:
(1)![]() 与S是同族元素,比S多1个电子层,Se在元素周期表的位置为______;
与S是同族元素,比S多1个电子层,Se在元素周期表的位置为______;![]() 的热稳定性比
的热稳定性比![]() 的热稳定性______
的热稳定性______![]() 填“强”或“弱”
填“强”或“弱”![]() .
.
(2)乙醇浸取后过滤所得滤渣的主要成分是______![]() 蒸发除去溶剂后,所得固体中仍含有少量
蒸发除去溶剂后,所得固体中仍含有少量![]() 杂质,除杂时适宜采用的方法是______.
杂质,除杂时适宜采用的方法是______.
(3)![]() 易溶于水得到
易溶于水得到![]() 溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式______.
溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式______.
(4)已知![]() 的电离常数
的电离常数![]() 、
、![]() ,回答下列问题:
,回答下列问题:
![]() 溶液呈______性,原因是
溶液呈______性,原因是![]() 用离子方程式表示
用离子方程式表示![]() ______;
______;
![]() 在
在![]() 溶液中,下列关系式正确的是______:
溶液中,下列关系式正确的是______:
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.在醋酸溶液的![]() ,将此溶液稀释1倍后,溶液的
,将此溶液稀释1倍后,溶液的![]() ,则
,则![]()
B.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
C.![]() 盐酸的
盐酸的![]() ,
,![]() 盐酸的
盐酸的![]()
D.若1mL![]() 的盐酸与100mL
的盐酸与100mL![]() 溶液混合后,溶液的
溶液混合后,溶液的![]() 则
则![]() 溶液的
溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或应用的说法正确的是( )
A.在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化
B.用核磁共振氢谱鉴1-丙醇2-丙醇
C.间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构
D.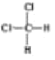 和
和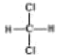 、
、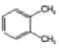 和
和![]() 属于同分异构体
属于同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2中的c(NH![]() )________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH
)________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是___________________;
②20℃时,0.1 mol/L NH4Al(SO4)2中2c(SO![]() )-c(NH
)-c(NH![]() )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
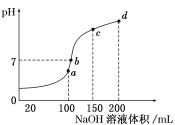
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.一定温度下,10mL 0.50mol·L-1 NH4Cl溶液与20mL 0.25mol·L-1 NH4C1溶液含NH4+物质的量相同
B.25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3·H2O的电离常数![]()
C.一定温度下,已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液中
CH3COO-+H+,加少量烧碱溶液可使溶液中![]() 值增大。
值增大。
D.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3,FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:
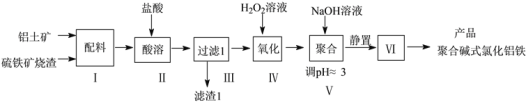
(1)步骤Ⅱ酸溶时,Fe2O3被溶解的化学程式为____,滤渣1的成分为____(填化学式)。
(2)步骤Ⅳ发生反应的离子方程式为________________。
(3)步骤V若将溶液pH调成6,可能造成的影响是_______;步骤Ⅵ包含的操作有_______。
(4)测定聚合碱式氯化铝铁{可表示为[FeaAlb(OH)xCly]n}中n(Al)/n(Fe)的比值的步骤如下:
步骤1.准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350 g固体。
步骤2.另准确称取2.855g样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.4000g。
计算产品中n(Al)/n(Fe)的比值(写出计算过程)。__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com