
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2中的c(NH![]() )________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH
)________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是___________________;
②20℃时,0.1 mol/L NH4Al(SO4)2中2c(SO![]() )-c(NH
)-c(NH![]() )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
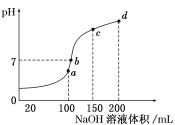
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________。
【答案】Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水 小于 Ⅰ NH4Al(SO4)2水解,溶液呈酸性,升高温度使其水解程度增大,pH减小 10-3mol/L a点 c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水 小于 Ⅰ NH4Al(SO4)2水解,溶液呈酸性,升高温度使其水解程度增大,pH减小 10-3mol/L a点 c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
【解析】
(1)Al3+水解生成的Al(OH)3胶体,具有吸附性;
(2)NH4Al(SO4)2水解,溶液呈酸性,NH4HSO4中的铵根离子水解显示酸性,根据铵根离子的水解程度来回答;
(3)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;②根据电荷守恒定律解题;①a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;
②依据电荷守恒得出结论;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离.b点溶液呈中性;b点溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3H2O,V(NaOH)>V(NH4HSO4)。
(1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水,
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水,
故答案为:Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水;
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水;
(2)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但NH4Al(SO4)2中Al3+水解呈酸性,会抑制NH4+的水解,HSO4-电离出的H+同样抑制NH4+的水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4Al(SO4)2中NH4+水解程度比NH4HSO4中的大,故0.1 mol/L NH4Al(SO4)2中的c(NH4+)小于0.1 mol/L NH4HSO4中的c(NH4+),
故答案为:小于;
(3)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ;
②20℃时,0.1 mol/L NH4Al(SO4)2溶液的pH=3,即c(H+)=10-3mol/L,c(OH-)较小,根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3mol/L- c(OH-)≈10-3mol/L,
故答案为:Ⅰ;NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小;10-3mol/L;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3·H2O,(NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,a点水的电离程度最大,b点溶液呈中性,即溶液中含有(NH4)2SO4、Na2SO4、NH3·H2O三种成分,a点时c(Na+)=c(SO42-),则b点时c(Na+)>c(SO42-),根据N原子与S原子数目相等以及N元素与S元素组成物质的关系,可以得出c(SO42-)>c(NH4+),故b点溶液中各离子浓度大小关系为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a点;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】在25 ℃时,向50.00 mL未知浓度的CH3COOH溶液中逐滴加入0.5 mol·L-1的NaOH溶液。滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中正确的是
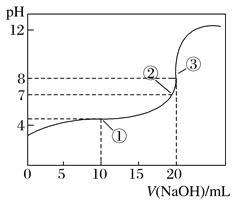
A.该中和滴定过程,最宜用石蕊作指示剂
B.图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度
C.图中点②所示溶液中,c(CH3COO-)=c(Na+)
D.滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为: 3Z = 3X+2Y
B. t0时,X、Y、Z的质量不再改变
C. t0时,Z的浓度为1.2 mol/L
D. t0时,反应停止,反应速率为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.0L的恒容密闭容器中进行可逆反应:![]() 。判断该可逆反应达到平衡状态的依据有( )
。判断该可逆反应达到平衡状态的依据有( )
A.单位时间内消耗X和Y的物质的量之比为1:2
B.容器内气体的压强不再随时间改变
C.容器内气体的密度不再随时间改变
D.气体Z的物质的量不再随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1L的恒容密闭容器中发生反应CO(g)+H2S(g)COS(g)+H2(g)△H=akJmol-1达到平衡。下列说法不正确的是
容器编号 | 温度/K | 物质的起始浓度/molL-1 | 物质的平衡浓度/molL-1 | |||
CO(g) | H2S(g) | COS(g) | H2(g) | COS(g) | ||
1 | T1 | 10.0 | 7.0 | 0 | 0 | 2.0 |
2 | T1 | 5.0 | 3.5 | 0 | 0 | |
3 | T2 | 3.0 | 0 | 7.0 | 7.0 | 1.5 |
A.若T1>T2,则a>0
B.T1K时,该反应的平衡常数K=0.1
C.容器3中反应达到平衡后,再充入1.1molH2S(g)和0.3molH2(g),平衡不移动
D.容器1中H2S的平衡转化率比容器2小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习中经常应用类推法。下列表格左边正确,类推法应用于右边也正确的是( )
A | 向FeCl2溶液中滴入氯水 2Fe2++Cl2=2Fe3++2Cl— | 向FeCl2溶液中滴入碘水 2Fe2++I2=2Fe3++2I— |
B | 向澄清石灰水中通入少量CO2气体 Ca2++2OH—+CO2 =CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 气体 Ca2++2OH—+SO2=CaSO3↓+H2O |
C | 向Na2CO3溶液中滴入稀HNO3
| 向Na2SO3溶液中滴入稀HNO3
|
D | 锌粒放入硫酸亚铁溶液中 Zn+Fe2+=Zn2++Fe | 钠投入硫酸铜溶液中 2Na+Cu2+=2Na++Cu |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是( )
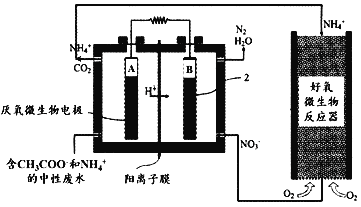
A.好氧微生物反应器中反应为:NH4++2O2=NO3-+2H++H2O
B.B极电势比A极电势低
C.A极的电极反应式CH3COO-+8e-+2H2O=2CO2+7H+
D.当电路中通过9mol电子时,理论上总共生成标况下33.6LN2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com