
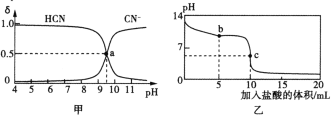
【题目】25℃时,向10 mL 0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,溶液中CN-、HCN物质的量分数(δ)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。溶液的pH变化曲线如图乙所示。下列溶液中的关系正确的是
A.图甲中pH=7的溶液:c(Cl-)<c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol·L-1
C.图乙中b点的溶液:c(HCN)>c(Cl-)>c(CN-)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
【答案】BC
【解析】
NaCN溶液中加入盐酸,发生反应NaCN+HCl==NaCl+HCN,当pH=9.5时,c(HCN)=c(CN-);当加入盐酸的体积为10mL时,NaCN与HCl刚好完全反应,生成HCN和NaCl。
A.图甲溶液中,存在电荷守恒c(Cl-)+ c(CN-)+ c(OH-)=c(Na+)+ c(H+),pH=7,c(OH-)=c(H+),所以c(Cl-)+c(CN-)=c(Na+);溶液中存在物料守恒c(Na+)=c(CN-)+c(HCN),故c(Cl-)=c(HCN),A不正确;
B.常温下,a点时,c(CN-)=c(HCN),pH=9.5,c(OH-)=10-4.5mol/L,NaCN的水解平衡常数:Kh(NaCN)=![]() = 10-4.5mol·L-1,B正确;
= 10-4.5mol·L-1,B正确;
C.图乙中b点时,发生反应后c(HCN)=c(Cl-)=c(CN-),此时溶液中CN-发生水解:CN-+H2O![]() HCN+OH-,水解反应后,c(HCN)增大,c(CN-)减小,所以溶液中:c(HCN)>c(Cl-)>c(CN-)>c(OH-)>c(H+),C正确;
HCN+OH-,水解反应后,c(HCN)增大,c(CN-)减小,所以溶液中:c(HCN)>c(Cl-)>c(CN-)>c(OH-)>c(H+),C正确;
D.图乙中c点的溶液中,发生反应NaCN+HCl==NaCl+HCN,且二者刚好完全反应,反应后,发生HCN的电离:HCN![]() H++CN-,离子间满足电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),物料守恒:c(Cl-)= c(HCN)+c(CN-),故c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-),D不正确;
H++CN-,离子间满足电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),物料守恒:c(Cl-)= c(HCN)+c(CN-),故c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-),D不正确;
故选BC。


科目:高中化学 来源: 题型:
【题目】某小组同学欲探究NH3催化氧化反应,按如图装置进行实验。
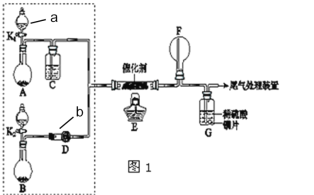
已知A、B装置可选药品:浓氨水、H2O2、蒸馏水、生石灰、MnO2。
(1)仪器a的名称为___;仪器b的名称为___。
(2)装置A烧瓶中固体的作用为___(填序号)
A.催化剂 B.氧化剂 C.还原剂 D.反应物
(3)仪器b中盛放的试剂可以是____(填序号)
A.浓硫酸 B.碱石灰 C.五氧化二磷 D.硫酸铜
(4)装置E中发生反应的化学方程式____。
(5)甲乙两同学分别按上述装置进行实验,一段时间后。
①甲观察到装置F中只有白烟生成,白烟的成分是___(写化学式)。
②乙观察到装置F中有红棕色气体,装置G中溶液变成蓝色。用离子方程式解释装置G中溶液变成蓝色的原因:___;
(6)为帮助甲实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进。你的改进措施是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是( )
A. 原子半径A<B<C
B. A的氢化物的稳定性小于C的氢化物的稳定性
C. C的氧化物的熔点比A的氧化物的低
D. A与C可形成原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某核素![]() 的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数为_________。
(2)若X的核内中子数为12,求47.5gXCl2中所含质子的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等。如果A中只含两种物质,则A中一定含有( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定Cu(NO3)2nH2O的结晶水含量,下列方案中肯定不可行的是( )
A.称量样品→加热→冷却→称量CuO
B.称量样品→加热→冷却→称量Cu(NO3)2
C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
D.称量样品→加NaOH→过滤→加热→冷却→称量CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
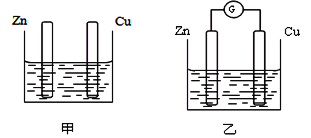
(1)以下叙述中,正确的是________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中SO42-向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为________;乙为____________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______________________ 。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应式__________________。当电路中转移0.2 mol电子时,消耗负极材料的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2NO(g)![]() N2(g)+O2(g) △H=-181.5 kJ/mol。某科研小组尝试利用固体表面催化工艺进行NO的分解。若用
N2(g)+O2(g) △H=-181.5 kJ/mol。某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
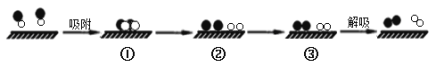
A.①B.②C.③D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
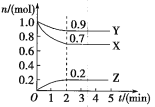
(1)该反应的化学方程式为:___。
(2)反应开始至2min,用Z表示的平均反应速率为:___。
(3)下列叙述能说明上述反应达到化学平衡状态的__(填序号):
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入amolX(g)和bmolY(g),发生反应X(g)+Y(g)═2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)?
①降低温度:__;②恒容通入氦气:___;③使用催化剂:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com