
【题目】测定Cu(NO3)2nH2O的结晶水含量,下列方案中肯定不可行的是( )
A.称量样品→加热→冷却→称量CuO
B.称量样品→加热→冷却→称量Cu(NO3)2
C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
D.称量样品→加NaOH→过滤→加热→冷却→称量CuO
【答案】B
【解析】
Cu(NO3)2受热易分解,其分解反应为:2Cu(NO3)2![]() 2CuO+4NO2↑+O2↑。
2CuO+4NO2↑+O2↑。
A.称量样品→加热→冷却→称量CuO,根据硝酸铜分解的方程式以及氧化铜的质量可测定Cu(NO3)2nH2O的结晶水含量,故A正确;
B.因硝酸铜易分解,称量样品→加热无法恰好使结晶水合物恰好分解为硝酸铜,故B错误;
C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量,根据水的质量以及结晶水合物的质量可以求解,故C正确;
D.称量样品→加NaOH将硝酸铜转化为氢氧化铜,→过滤→加热氢氧化铜分解生成氧化铜→冷却→称量CuO,根据铜原子守恒求解无水硝酸铜的质量,据此求解结晶水含量,故D正确;
故答案为B。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】《Journal of Energy Chemistry》报道我国科学家设计![]() 熔盐捕获与转化装置如图。下列有关说法正确的是( )
熔盐捕获与转化装置如图。下列有关说法正确的是( )
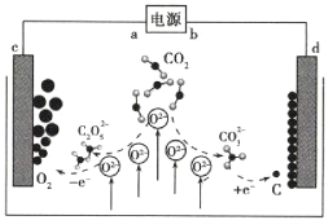
A.![]() 为负极
为负极
B.熔盐可用![]() 溶液代替
溶液代替
C.转移![]() 电子可捕获
电子可捕获![]() (标准状况下)
(标准状况下)
D.![]() 的电极反应式为
的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品保鲜膜按材质分别为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等种类。其中PE和PVDC是安全的。PVC对人体的潜在危害主要来源于两个方面:产品中氯乙烯单体残留量、加工过程中使用的加工助剂的种类及含量。
(1)写出用乙烯、氯乙烯分别生产聚乙烯和聚氯乙烯的化学方程式:
乙烯→聚乙烯(PE):__________________________________________
氯乙烯→聚氯乙烯(PVC):____________________________________
日常用的食品保鲜膜宜选用____________。
(2)目前出现的“不粘锅”、不粘油的吸油烟机等新型厨具,其秘密就是表面有一种叫做“特富龙”的涂层,实际上就是被称为“塑料王”的聚四氟乙烯。它的单体四氟乙烯的结构简式是_______________,合成特富龙的反应类型是___________,反应方程式为_________________。
(3)聚四氟乙烯的发现源于一次实验意外。1938年,化学家普鲁凯特与助手们研究四氟乙烯的聚合反应,他们将四氟乙烯贮存在冷藏箱中的加压钢瓶中,当将钢瓶与反应器管道、反应器(管道及反应器间隙有空气)接通后,发生故障,四氟乙烯气体并没有通到反应器中,经称重证明钢瓶中气体一点没减少,打开阀门也没有四氟乙烯气体逸出,但拆卸阀门后却从钢瓶倒出与四氟乙烯等重的白色粉末,即四氟乙烯已在钢瓶中发生了聚合反应。后经确证,该白色粉末就是聚四氟乙烯。1945年,美国杜邦公司开始在工业规模上生产聚四氟乙烯,由此可以推知该反应的条件是___________、____________、____________引发。
(4)不粘锅的内壁有一薄层聚四氟乙烯涂层,因此用不粘锅烧饭菜时不易粘锅,下列说法正确的是(______)
a.聚四氟乙烯分子中没有双键 b.聚四氟乙烯的单体是不饱和烃
c.聚四氟乙烯的化学性质很不活泼 d.聚四氟乙烯的熔沸点很低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用环己醇(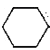 —OH)与85%磷酸在共热条件下制取环已烯(
—OH)与85%磷酸在共热条件下制取环已烯(![]() ),制备装置如图所示。
),制备装置如图所示。
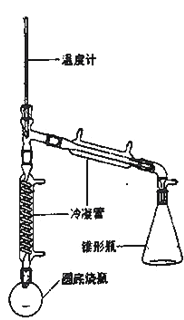
实验药品的物理性质:
名称 | 密度(g/mL) | 熔点℃ | 沸点℃ | 溶解性 |
环己醇 | 0.96 | 25.2 | 161 | 微溶于水 |
环己烯 | 0.81 | -103 | 83 | 不溶于水 |
85% H3PO4 | 1.68 | 42.35 | 213(失水) | 易溶于水 |
已知:环己醇能与水形成二元共沸物(含水80%),其沸点为97.8℃
实验原理:
(1)该实验的反应原理与实验室制乙烯相似,请用化学方程式表示______。
(2)该反应有副反应发生(产物为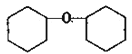 ),反应的方程式为____。
),反应的方程式为____。
II.制备粗产品:
(3)在圆底烧瓶中加入20mL(9.6g)环己醇、10mL 85% H3PO4几粒碎瓷片,用电热包均匀缓慢加热。温度计的温度不应超过90℃,原因是____;85% H3PO4在反应中的作用是____;碎瓷片的作用是_____。
Ⅲ.粗产品提纯
(4)从分液漏斗中分离出来的环己烯还要转移到蒸馏烧瓶中,并加入少量的无水氯化钙进一步蒸馏,此时温度计下端的水银球应插在蒸馏烧瓶的_____位置,温度计显示的温度应为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,溶液中CN-、HCN物质的量分数(δ)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。溶液的pH变化曲线如图乙所示。下列溶液中的关系正确的是
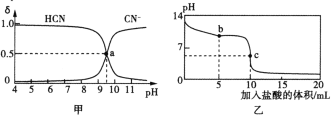
A.图甲中pH=7的溶液:c(Cl-)<c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol·L-1
C.图乙中b点的溶液:c(HCN)>c(Cl-)>c(CN-)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究NaHSO3溶液分别与CuCl2、CuSO4溶液的反应。

已知:①![]() (深蓝色溶液)
(深蓝色溶液)
②![]()
回答下列问题:
(1)实验Ⅰ产生的无色气体为SO2。用蘸有碘水的淀粉试纸接近试管口,观察到_________________________,反应的离子方程式为______________________。
(2)对实验Ⅰ产生SO2的原因进行分析,提出两种假设:
①Cu2+水解使溶液中c(H+)增大;
②Cl-存在时,Cu2+与![]() 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
实验证明,①不合理,实验证据是____________________;②合理,实验Ⅰ反应的离子方程式有_________________________、H++![]() =SO2↑+H2O。
=SO2↑+H2O。
(3)通过分析实验Ⅰ、Ⅱ,可知:Cl-增强了Cu2+的氧化性。下述实验证实了此结论。实验方案:闭合K,电压表的指针偏转至“x”处;向U形管___________(补全实验操作及现象)。装置中,盐桥的作用是______________________________(答出两条即可)。
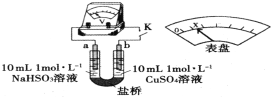
(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和![]() 。设计实验,证明红色沉淀中含有Cu+__________________。
。设计实验,证明红色沉淀中含有Cu+__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是向MgCl2、AlCl3混合液中依次加入M和N时生成沉淀的物质的量与加入的M和N的体积关系图(M、N各表示盐酸或氢氧化钠溶液中的一种),以下结论正确的是( )
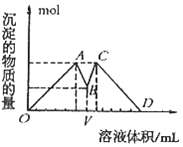
A.混合溶液中c(AlCl3):c(MgCl2)=1:1
B.混合溶液中c(AlCl3):c(MgCl2)=3:1
C.V之前加盐酸,V之后加NaOH溶液
D.这种盐酸与NaOH溶液中溶质的物质的量浓度为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼[(CH3)2N—NH2]与N2O4是常用的火箭推进剂,火箭发射时常出现红棕色气体,发生的化学反应如下:
① (CH3)2N—NH2(l) + 2N2O4(l) = 2CO2(g) + 3N2(g) + 4H2O(g) H1<0
② N2O4(l) ![]() 2NO2(g) H2 >0
2NO2(g) H2 >0
下列说法不正确的是
A.反应①中,N2O4为氧化剂
B.反应①中,生成1mol CO2时,转移8 mol e-
C.由反应②推断:加压、降温是获得液态N2O4的条件
D.温度升高,反应①的化学反应速率减小、反应②的化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量之比为1:1的Fe、Cu的混合粉末逐渐加入到含1mol![]() 的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
A.14gB.15gC.18gD.22.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com