
【题目】实验室用环己醇(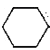 —OH)与85%磷酸在共热条件下制取环已烯(
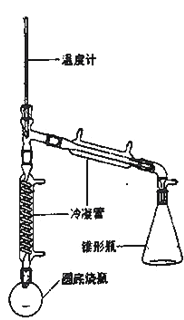
—OH)与85%磷酸在共热条件下制取环已烯(![]() ),制备装置如图所示。
),制备装置如图所示。
实验药品的物理性质:
名称 | 密度(g/mL) | 熔点℃ | 沸点℃ | 溶解性 |
环己醇 | 0.96 | 25.2 | 161 | 微溶于水 |
环己烯 | 0.81 | -103 | 83 | 不溶于水 |
85% H3PO4 | 1.68 | 42.35 | 213(失水) | 易溶于水 |
已知:环己醇能与水形成二元共沸物(含水80%),其沸点为97.8℃
实验原理:
(1)该实验的反应原理与实验室制乙烯相似,请用化学方程式表示______。
(2)该反应有副反应发生(产物为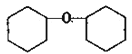 ),反应的方程式为____。
),反应的方程式为____。
II.制备粗产品:
(3)在圆底烧瓶中加入20mL(9.6g)环己醇、10mL 85% H3PO4几粒碎瓷片,用电热包均匀缓慢加热。温度计的温度不应超过90℃,原因是____;85% H3PO4在反应中的作用是____;碎瓷片的作用是_____。
Ⅲ.粗产品提纯
(4)从分液漏斗中分离出来的环己烯还要转移到蒸馏烧瓶中,并加入少量的无水氯化钙进一步蒸馏,此时温度计下端的水银球应插在蒸馏烧瓶的_____位置,温度计显示的温度应为_____。
【答案】![]() —OH
—OH![]()
![]() +H2O
+H2O ![]() —OH
—OH![]()
![]() —O—
—O—![]() +H2O 防止环己醇挥发出来(或提高反应物环己醇的转化率) 催化剂、脱水剂 防止暴沸 支管口处 83℃
+H2O 防止环己醇挥发出来(或提高反应物环己醇的转化率) 催化剂、脱水剂 防止暴沸 支管口处 83℃
【解析】
I(1).实验室制乙烯是由乙醇和浓硫酸在170度反应制得,发生消去反应,该实验的反应原理与实验室制乙烯相似,则正确的化学方程式为![]() —OH
—OH![]()
![]() +H2O,
+H2O,
答案为:![]() —OH
—OH![]()
![]() +H2O;
+H2O;
(2).该反应有副反应发生,醇和醇脱水缩合会生成醚,![]() —OH
—OH![]()
![]() —O—
—O—![]() +H2O;
+H2O;
答案为:![]() —OH
—OH![]()
![]() —O—
—O—![]() +H2O;
+H2O;
II(3).加入10mL 85% H3PO4能吸水,H3PO4是常见的脱水剂和催化剂;几粒碎瓷片,是为了防止暴沸 ,用电热包均匀缓慢加热;温度计的温度不应超过90℃是因为环己醇的沸点比较低,如果温度太高,超过90度,会使原料和产物一起蒸出,从而降低反应物环己醇的转化率;
答案为:防止环己醇挥发出来(或提高反应物环己醇的转化率;催化剂、脱水剂;防止暴沸;
(4)从分液漏斗中分离出来的环己烯还要转移到蒸馏烧瓶中,环己烯的沸点是83℃,要分开环己烯和水,无水氯化钙是常用的干燥剂,要加入少量的无水氯化钙进一步蒸馏除去水,此时温度计下端的水银球应插在蒸馏烧瓶的支管口处;
答案为:支管口处;83℃。


科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。如图所示装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
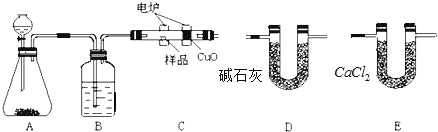
回答下列问题:
(1)若A中装有二氧化锰固体,发生反应的化学方程式为_____。
(2)B装置的作用是_____,燃烧管C中CuO的作用是_____。
(3)产生氧气按从左向右流向,燃烧管C与装置D、E的连接顺序是:C→____→____。
(4)准确称取1.8g 烃的含氧衍生物X 的样品,经充分燃烧后,D管质量增加2.64g,E管质量增加1.08g,则该有机物的实验式(即最简式)是____,实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为_____,1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1:1,X可能的结构简式为_____(任写一种合理结构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸和![]() 制
制![]() ,并以干燥的
,并以干燥的![]() 为原料进行实验,装置如下图所示。
为原料进行实验,装置如下图所示。
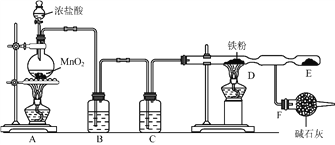
⑴装置![]() 烧瓶中发生反应的化学方程式为:_________________________________。
烧瓶中发生反应的化学方程式为:_________________________________。
⑵装置![]() 、
、![]() 中应盛放的试剂名称分别为__________、_________;从
中应盛放的试剂名称分别为__________、_________;从![]() 装置导出的气体若不经过
装置导出的气体若不经过![]() 、
、![]() 装置而直接进入
装置而直接进入![]() 管,将对实验产生的不良后果是___________________________。
管,将对实验产生的不良后果是___________________________。
⑶实验时,先点燃![]() 处的酒精灯,让氯气充满装置,再点燃
处的酒精灯,让氯气充满装置,再点燃![]() 处酒精灯,写出
处酒精灯,写出![]() 中反应的化学方程式:_________________________________________。
中反应的化学方程式:_________________________________________。
⑷![]() 装置所起的作用是____________________,____________________。
装置所起的作用是____________________,____________________。
⑸用廉价的石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式:
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)HClO 分子中各原子均满足稳定结构。写出 HClO 的电子式_____。
(2)碳酸氢钠水溶液呈碱性,试分析原因:_____(用离子方程式表示)。
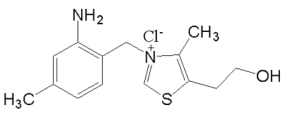
(3)维生素 B1 的结构简式如图所示,维生素 B1 晶体溶于水的过程, 需要克服的微粒间作用力,除范德华力外还有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某核素![]() 的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数为_________。
(2)若X的核内中子数为12,求47.5gXCl2中所含质子的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,三种盐的沉淀溶解平衡曲线如图所示,已知pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,下列说法正确的是( )
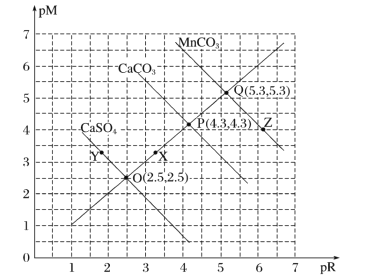
A.Y点:c(Ca2+)>c(SO42-),Z点:c(CO32-)>c(Mn2+)
B.溶度积:Ksp(MnCO3)>Ksp(CaCO3)>Ksp(CaSO4)
C.X点对应的CaCO3溶液为不饱和溶液,可以继续溶解CaCO3
D.T℃时,CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)的平衡常数K的数量级为103
CaCO3(s)+SO42-(aq)的平衡常数K的数量级为103
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定Cu(NO3)2nH2O的结晶水含量,下列方案中肯定不可行的是( )
A.称量样品→加热→冷却→称量CuO
B.称量样品→加热→冷却→称量Cu(NO3)2
C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
D.称量样品→加NaOH→过滤→加热→冷却→称量CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,X与Y位于不同周期,X与W位于同一主族;原子最外层电子数之比N(Y):N(Q)=3:4;Z的原子序数等于Y、W、Q三种元素原子的最外层电子数之和。请回答下列问题:
(1)Y元素在周期表中的位置是______________;QX4的电子式为_____________。
(2)一种名为“PowerTrekk”的新型充电器是以化合物W2Q和X2Z为原料设计的,这两种化合物相遇会反应生成W2QZ3和气体X2,利用气体X2组成原电池提供能量。
①写出W2Q和X2Z反应的化学方程式:______________。
②以稀硫酸为电解质溶液,向两极分别通入气体X2和Z2可形成原电池,其中通入气体X2的一极是_______(填“正极”或“负极”)。
③若外电路有3mol电子转移,则理论上需要W2Q的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在测定空气里氧气含量的实验中,小明采用了如图所用的装置:
装置一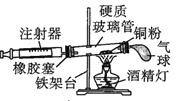 装置二
装置二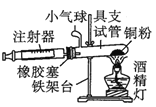
在由注射器和硬质玻璃管组成的密闭系统中留有40mL空气,给装有铜粉的玻璃管加热,观察密闭系统内空气体积变化。
(1)在实验加热过程中,缓慢推动注射器活塞的目的是__________。
(2)装置一比装置二更______(填“合理”或“不合理”),理由是_________。
(3)小明测得的实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
15mL | 10mL |
由此数据可推算出他测定的氧气的体积分数________21%(填“>”“<”或“=”),造成该实验出现误差的原因可能是____________(填序号)。
①推动注射器活塞速度太快 ②未冷却至室温就读数 ③加入铜粉量太少
Ⅱ.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。
图甲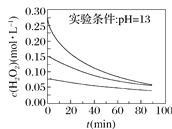 图乙
图乙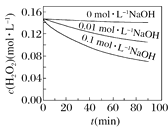
(4)根据上图,将不同条件对速率的影响情况补充完整:图甲表明,____________,H2O2分解速率越快;图乙表明,_________,H2O2分解速率越快。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com