
【题目】(1)HClO 分子中各原子均满足稳定结构。写出 HClO 的电子式_____。
(2)碳酸氢钠水溶液呈碱性,试分析原因:_____(用离子方程式表示)。
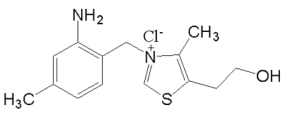
(3)维生素 B1 的结构简式如图所示,维生素 B1 晶体溶于水的过程, 需要克服的微粒间作用力,除范德华力外还有_____。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响。
(2)其中V1=___、T1=__;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=___。
(3)若t1<8,则由此实验可以得出的结论是___;
(4)忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,错误的是 ( )
A.配制 5%食盐溶液时,称量 5g 食盐放入烧杯中加入 95g 水搅拌溶解
B.胆矾晶体结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知 NaOH 溶液浓度时,红色手柄滴定管需用标准酸液润洗 2﹣3 次
D.配制 0.1 mol/L 的 H2SO4 溶液时,将量取的浓 H2SO4 放入容量瓶中加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
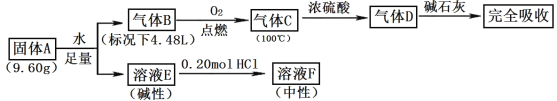
【题目】Ⅰ.由三种常见元素组成的化合物A,按如下流程进行实验。气体B、C、D均无色、无臭,B、D是纯净物;浓硫酸增重3.60g,碱石灰增重17.60g;溶液F焰色反应呈黄色。
请回答:
(1)组成A的非金属元素是_____,气体B的结构简式_____。
(2)固体A与足量水反应的化学方程式是_____。
(3)一定条件下,气体D可能和FeO发生氧化还原反应,试写出一个可能的化学方程式_____。
Ⅱ.某兴趣小组为验证卤素单质的氧化性强弱,向NaBr溶液中通入一定量Cl2,将少量分液漏斗中溶液滴入试管中,取试管振荡,静止后观察现象。实验装置如图:
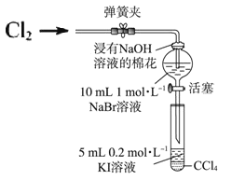
(4)说明氧化性 Br2>I2 的实验现象是_____。
(5)为了排除Cl2对溴置换碘实验的干扰,需确认分液漏斗中通入Cl2 未过量。试设计简单实验方案检____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品保鲜膜按材质分别为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等种类。其中PE和PVDC是安全的。PVC对人体的潜在危害主要来源于两个方面:产品中氯乙烯单体残留量、加工过程中使用的加工助剂的种类及含量。
(1)写出用乙烯、氯乙烯分别生产聚乙烯和聚氯乙烯的化学方程式:
乙烯→聚乙烯(PE):__________________________________________
氯乙烯→聚氯乙烯(PVC):____________________________________
日常用的食品保鲜膜宜选用____________。
(2)目前出现的“不粘锅”、不粘油的吸油烟机等新型厨具,其秘密就是表面有一种叫做“特富龙”的涂层,实际上就是被称为“塑料王”的聚四氟乙烯。它的单体四氟乙烯的结构简式是_______________,合成特富龙的反应类型是___________,反应方程式为_________________。
(3)聚四氟乙烯的发现源于一次实验意外。1938年,化学家普鲁凯特与助手们研究四氟乙烯的聚合反应,他们将四氟乙烯贮存在冷藏箱中的加压钢瓶中,当将钢瓶与反应器管道、反应器(管道及反应器间隙有空气)接通后,发生故障,四氟乙烯气体并没有通到反应器中,经称重证明钢瓶中气体一点没减少,打开阀门也没有四氟乙烯气体逸出,但拆卸阀门后却从钢瓶倒出与四氟乙烯等重的白色粉末,即四氟乙烯已在钢瓶中发生了聚合反应。后经确证,该白色粉末就是聚四氟乙烯。1945年,美国杜邦公司开始在工业规模上生产聚四氟乙烯,由此可以推知该反应的条件是___________、____________、____________引发。
(4)不粘锅的内壁有一薄层聚四氟乙烯涂层,因此用不粘锅烧饭菜时不易粘锅,下列说法正确的是(______)
a.聚四氟乙烯分子中没有双键 b.聚四氟乙烯的单体是不饱和烃
c.聚四氟乙烯的化学性质很不活泼 d.聚四氟乙烯的熔沸点很低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有相同温度和压强下的两种气体12C18O和14N2,若两种气体的质量相同,则两种气体所含的质子数之比为__________,若两种气体的原子数相等,则两种气体所含中子数之比_________,若两种气体的体积相同,则两种气体的密度之比为_________。
(2)10.8 g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为 ________。
(3)将10 mL1.00 mol/L Na2CO3溶液与10 mL1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为___________(忽略混合前后溶液体积的变化)。
(4)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是_________。
(5)在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用环己醇( —OH)与85%磷酸在共热条件下制取环已烯(
—OH)与85%磷酸在共热条件下制取环已烯(![]() ),制备装置如图所示。
),制备装置如图所示。
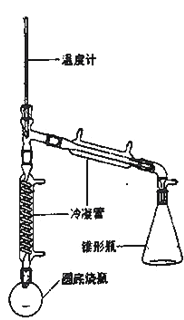
实验药品的物理性质:
名称 | 密度(g/mL) | 熔点℃ | 沸点℃ | 溶解性 |
环己醇 | 0.96 | 25.2 | 161 | 微溶于水 |
环己烯 | 0.81 | -103 | 83 | 不溶于水 |
85% H3PO4 | 1.68 | 42.35 | 213(失水) | 易溶于水 |
已知:环己醇能与水形成二元共沸物(含水80%),其沸点为97.8℃
实验原理:
(1)该实验的反应原理与实验室制乙烯相似,请用化学方程式表示______。
(2)该反应有副反应发生(产物为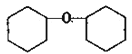 ),反应的方程式为____。
),反应的方程式为____。
II.制备粗产品:
(3)在圆底烧瓶中加入20mL(9.6g)环己醇、10mL 85% H3PO4几粒碎瓷片,用电热包均匀缓慢加热。温度计的温度不应超过90℃,原因是____;85% H3PO4在反应中的作用是____;碎瓷片的作用是_____。
Ⅲ.粗产品提纯
(4)从分液漏斗中分离出来的环己烯还要转移到蒸馏烧瓶中,并加入少量的无水氯化钙进一步蒸馏,此时温度计下端的水银球应插在蒸馏烧瓶的_____位置,温度计显示的温度应为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究NaHSO3溶液分别与CuCl2、CuSO4溶液的反应。

已知:①![]() (深蓝色溶液)
(深蓝色溶液)
②![]()
回答下列问题:
(1)实验Ⅰ产生的无色气体为SO2。用蘸有碘水的淀粉试纸接近试管口,观察到_________________________,反应的离子方程式为______________________。
(2)对实验Ⅰ产生SO2的原因进行分析,提出两种假设:
①Cu2+水解使溶液中c(H+)增大;
②Cl-存在时,Cu2+与![]() 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
实验证明,①不合理,实验证据是____________________;②合理,实验Ⅰ反应的离子方程式有_________________________、H++![]() =SO2↑+H2O。
=SO2↑+H2O。
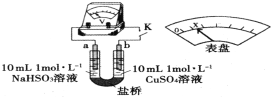
(3)通过分析实验Ⅰ、Ⅱ,可知:Cl-增强了Cu2+的氧化性。下述实验证实了此结论。实验方案:闭合K,电压表的指针偏转至“x”处;向U形管___________(补全实验操作及现象)。装置中,盐桥的作用是______________________________(答出两条即可)。
(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和![]() 。设计实验,证明红色沉淀中含有Cu+__________________。
。设计实验,证明红色沉淀中含有Cu+__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成n mol NO的同时,消耗n mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v逆(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com