
【题目】按要求填空:
(1)有相同温度和压强下的两种气体12C18O和14N2,若两种气体的质量相同,则两种气体所含的质子数之比为__________,若两种气体的原子数相等,则两种气体所含中子数之比_________,若两种气体的体积相同,则两种气体的密度之比为_________。
(2)10.8 g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为 ________。
(3)将10 mL1.00 mol/L Na2CO3溶液与10 mL1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为___________(忽略混合前后溶液体积的变化)。
(4)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是_________。
(5)在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_______________。
【答案】14:15 8:7 15:14 14 1.00mol/L 1:3 Co3O4
【解析】
(1)根据n=![]() 计算气体的物质的量,然后根据其分子中含有的质子数计算气体中含有的质子数关系;根据两种物质分子都是双原子分子,可确定若两种气体的原子数相等则分子数相等,根据n=
计算气体的物质的量,然后根据其分子中含有的质子数计算气体中含有的质子数关系;根据两种物质分子都是双原子分子,可确定若两种气体的原子数相等则分子数相等,根据n=![]() 及原子构成关系确定中子数的比,然后根据
及原子构成关系确定中子数的比,然后根据![]() 比较密度;
比较密度;
(2)根据O原子数计算O原子的物质的量,结合化合物的组成确定R2O5的物质的量,再根据n=![]() 计算气体的摩尔质量,进而可得R的相对原子质量;
计算气体的摩尔质量,进而可得R的相对原子质量;
(3)在过程中Na+的物质的量不变,根据c=![]() 计算;
计算;
(4)先根据n=![]() 计算的物质的量,根据二者的非物质的量和质量关系可计算出各自的物质的量,然后可得气体的物质的量的比;
计算的物质的量,根据二者的非物质的量和质量关系可计算出各自的物质的量,然后可得气体的物质的量的比;
(5)由CO2的体积计算其物质的量,根据元素守恒计算Co的物质的量,再根据O元素守恒,根据化合物的质量及其中含有的Co的质量计算出氧化物中O的物质的量,据此解答。
(1)相同状况下的两种气体12C18O和14N2,摩尔质量M(12C18O)=30g/mol,M(14N2)=28g/mol,两种气体的质量相等,假设气体的质量都是mg,依据n=![]() 可得到物质的量n(12C18O)=
可得到物质的量n(12C18O)=![]() mol,n(14N2)=
mol,n(14N2)=![]() mol,则n(12C18O):n(14N2)=14:15。由n=
mol,则n(12C18O):n(14N2)=14:15。由n=![]() 知物质分子的个数之比即为物质的量之比,其分子中含有的质子数12C18O为6+8=14,14N2为7×2=14,二者分子中所含质子数相等,因此分子数的比等于二者所含质子数之比=14:15;
知物质分子的个数之比即为物质的量之比,其分子中含有的质子数12C18O为6+8=14,14N2为7×2=14,二者分子中所含质子数相等,因此分子数的比等于二者所含质子数之比=14:15;
由于两种物质都是双原子分子,若两种气体的原子数相等,则二者的分子数相等,根据n=![]() 可知两种气体的物质的量相等,在12C18O中含有16个中子,在14N2中含有14个中子,所以二者中子数的比为16:14=8:7;在同温同压下,若两种气体的体积相同,则二者含有的气体分子数相等,根据
可知两种气体的物质的量相等,在12C18O中含有16个中子,在14N2中含有14个中子,所以二者中子数的比为16:14=8:7;在同温同压下,若两种气体的体积相同,则二者含有的气体分子数相等,根据![]() 可知两种气体的密度比气体的摩尔质量成正比,给密度比=30:28=15:14;
可知两种气体的密度比气体的摩尔质量成正比,给密度比=30:28=15:14;
(2)10.8 g R2O5中氧原子的数目为3.01×1023,n(O)=![]() =0.5mol,n(R2O5)=
=0.5mol,n(R2O5)=![]() n(O)=0.1mol,所以M(R2O5)=
n(O)=0.1mol,所以M(R2O5)=![]() =108g/mol,则元素R的相对原子质量为(108-5×16)÷2=14;
=108g/mol,则元素R的相对原子质量为(108-5×16)÷2=14;
(3)在过程中Na+的物质的量不变,n(Na+)=2n(Na2CO3)=2cV=2×1.00mol/L×0.01L=0.02mol,两种溶液混合后溶液的体积V0.02L,所以混合后溶液中Na+的物质的量浓度c(Na+)=![]() =1.00mol/L;
=1.00mol/L;
(4)在标准状况下,由CO和CO2组成的混合气体为6.72 L,物质的量是n=![]() =0.3mol,气体质量为12 g,假设混合气体中含有CO、CO2的物质的量分别是x、y,则x+y=0.3mol,28x+44y=12g,解得x=0.075mol,y=0.225mol,所以此混合物中CO和CO2物质的量之比是0.075mol :0.225mol =1:3;
=0.3mol,气体质量为12 g,假设混合气体中含有CO、CO2的物质的量分别是x、y,则x+y=0.3mol,28x+44y=12g,解得x=0.075mol,y=0.225mol,所以此混合物中CO和CO2物质的量之比是0.075mol :0.225mol =1:3;
(5)在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g, CO2的体积为1.344L(标准状况),n(CO2)=![]() =0.06mol,由化学式可知n(Co)=0.06mol×
=0.06mol,由化学式可知n(Co)=0.06mol×![]() =0.03mol,则氧化物中n(O)=
=0.03mol,则氧化物中n(O)=![]() =0.04mol,则n(Co):n(O)=0.03mol:0.04mol=3:4,所以钴氧化物的化学式为Co3O4。
=0.04mol,则n(Co):n(O)=0.03mol:0.04mol=3:4,所以钴氧化物的化学式为Co3O4。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)甲基的电子式_________________
(2)电石气的结构式_______________
(3)相对分子质量为72且沸点最低的烷烃的结构简式____________
(4)聚2﹣丁烯的结构简式___________________________
(5)与H2加成生成2,5﹣二甲基己烷的炔烃的系统命名_________________
(6)![]() 的系统命名__________________________
的系统命名__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种气态烃组成的混合物,体积为10ml与过量的氧气混合再充分燃烧,将生成物通过浓H2SO4气体体积减少15ml,再通过碱石灰气体体积又减少20ml [气体体积均为同温(120℃)同压(101kPa)]。混合烃的组成可能为( )
A. C2H6和C2H4 B. C2H4和C2H2 C. CH4和C3H4 D. C4H10和C2H4[来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,水的电离达到平衡:H2O![]() H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是
A. 将水加热,平衡向正反应方向移动,Kw不变
B. 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C. 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D. 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用氯气。
I.工业上通常采用电解法制氯气:观察图1,回答:
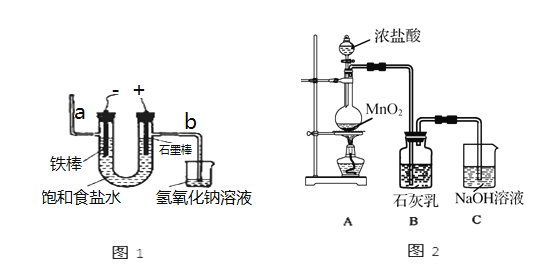
(1)电解反应的化学方程式为__________。
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是___________。
Ⅱ.某兴趣小组设计如图2所示的实验装置,利用氯气与石灰乳反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(3)B中反应的化学方程式是_________。
(4)该兴趣小组用100mL12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2____g。
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在装置B中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施_______。
②试判断另一个副反应(用化学方程式表示)_________,为避免此副反应的发生,可将装置做何改进_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,可能含有以下离子中的几种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现取三份各100mL溶液进行如下实验: 第一份加入
现取三份各100mL溶液进行如下实验: 第一份加入![]() 溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到
溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到![]() 气体;第三份加足量
气体;第三份加足量![]() 溶液后,得到干燥沉淀
溶液后,得到干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 。你认为以下结论正确的是
。你认为以下结论正确的是
A. 该混合液中一定含有:![]() 、
、![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() ,且
,且![]()
B. 该混合液中一定含有:![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() 、
、![]()
C. 该混合液中一定含有:![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() 、
、![]() 、
、![]()
D. 该混合液中一定含有:![]() 、
、![]() ,可能含
,可能含![]() 、
、![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是

A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将117 g NaCl溶于水配制成1 L溶液。
(1)该溶液中NaCl的物质的量浓度为________,溶液中Cl-的物质的量浓度为________。
(2)配制1 mol·L-1的NaCl溶液500 mL,需该溶液的体积为________。
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol·L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为________,通入HCl气体的体积(标准状况下)为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com