
【题目】T℃时,三种盐的沉淀溶解平衡曲线如图所示,已知pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,下列说法正确的是( )
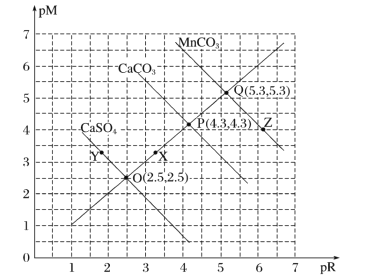
A.Y点:c(Ca2+)>c(SO42-),Z点:c(CO32-)>c(Mn2+)
B.溶度积:Ksp(MnCO3)>Ksp(CaCO3)>Ksp(CaSO4)
C.X点对应的CaCO3溶液为不饱和溶液,可以继续溶解CaCO3
D.T℃时,CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)的平衡常数K的数量级为103
CaCO3(s)+SO42-(aq)的平衡常数K的数量级为103
【答案】D
【解析】
pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,说明数值越大,对应的离子浓度越小;根据O、P、Q三点可求出MnCO3、CaCO3、CaSO4的Ksp值,即可比较溶解度大小;若Qc值大于Ksp,则有沉淀生成。
A.Y点pM大于3,pR小于3,则阴离子浓度大于阳离子浓度,即c(SO42-)>c(Ca2+);同理,Z点c(Mn2+)>c(CO32-),A项错误;
B.根据O、P、Q三点求MnCO3、CaCO3、CaSO4的Ksp值,![]() ;同理可得,Ksp(CaCO3)=10-8.6;Ksp(CaSO4)=10-5,故溶度积:Ksp(MnCO3)<Ksp(CaCO3)<Ksp(CaSO4),B项错误;
;同理可得,Ksp(CaCO3)=10-8.6;Ksp(CaSO4)=10-5,故溶度积:Ksp(MnCO3)<Ksp(CaCO3)<Ksp(CaSO4),B项错误;
C.横纵坐标分别为对应离子浓度的负对数,据图可知,X点的Qc值大于Ksp(CaCO3),有沉淀生成,不能再溶解CaCO3,C项错误;
D.T℃时,CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)的平衡常数K=
CaCO3(s)+SO42-(aq)的平衡常数K=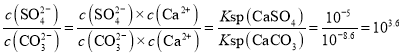 ,数量级为103,D项正确;
,数量级为103,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】亚硫酰氯(SOC12)又名氯化亚砜,其熔点一105℃,沸点79℃,140℃以上时易分解。是一种无色或淡黄色发烟液体,遇水剧烈与水反应生成SO2和另一酸性气体,常用作脱水剂,广泛应用于医药、农药、来料工业及有机合成工业。
(1)氯化亚砜储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是___;用硫黄、液氯和三氧化硫为原料在一定条件可合成氯化亚砜,如果想达到原子利用率最大化,则三者的物质的量之比为___。
(2)实验室合成SOCl2的原理之一为SO2+Cl2+SCl2![]() 2SOCl2,部分装置如图所示。
2SOCl2,部分装置如图所示。
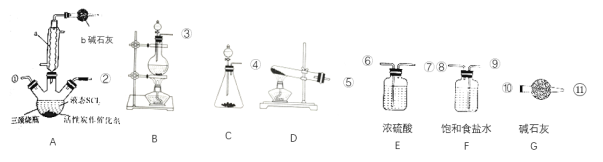
①装置b的作用是___。
②实验室制取SOCl2所选仪器的链接顺序:③→___。
(3)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。选用装置如图: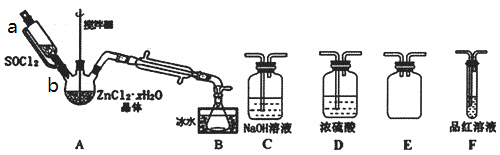
①向仪器A中缓慢滴加SOCl2,需打开活塞___(填“a”、“b”或“a和b”)。
②为了更加充分的回收SOCl2,写出可对装置B采取的有效措施___。
(4)乙同学认为利用(3)中装置,由FeCl3·6H2O制取无水FeCl3也可用SOCl2作脱水剂,但丙同学认为会发生氧化还原反应而难以制无水FeCl3。丙同学设计了如下实验方案验证自己的观点:
取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,加入___,证明该过程发生了氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.由三种常见元素组成的化合物A,按如下流程进行实验。气体B、C、D均无色、无臭,B、D是纯净物;浓硫酸增重3.60g,碱石灰增重17.60g;溶液F焰色反应呈黄色。
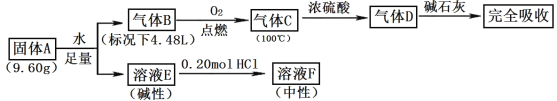
请回答:
(1)组成A的非金属元素是_____,气体B的结构简式_____。
(2)固体A与足量水反应的化学方程式是_____。
(3)一定条件下,气体D可能和FeO发生氧化还原反应,试写出一个可能的化学方程式_____。
Ⅱ.某兴趣小组为验证卤素单质的氧化性强弱,向NaBr溶液中通入一定量Cl2,将少量分液漏斗中溶液滴入试管中,取试管振荡,静止后观察现象。实验装置如图:
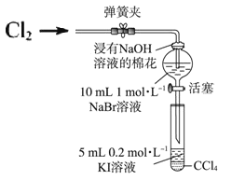
(4)说明氧化性 Br2>I2 的实验现象是_____。
(5)为了排除Cl2对溴置换碘实验的干扰,需确认分液漏斗中通入Cl2 未过量。试设计简单实验方案检____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有相同温度和压强下的两种气体12C18O和14N2,若两种气体的质量相同,则两种气体所含的质子数之比为__________,若两种气体的原子数相等,则两种气体所含中子数之比_________,若两种气体的体积相同,则两种气体的密度之比为_________。
(2)10.8 g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为 ________。
(3)将10 mL1.00 mol/L Na2CO3溶液与10 mL1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为___________(忽略混合前后溶液体积的变化)。
(4)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是_________。
(5)在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用环己醇(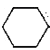 —OH)与85%磷酸在共热条件下制取环已烯(
—OH)与85%磷酸在共热条件下制取环已烯(![]() ),制备装置如图所示。
),制备装置如图所示。
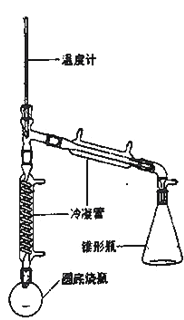
实验药品的物理性质:
名称 | 密度(g/mL) | 熔点℃ | 沸点℃ | 溶解性 |
环己醇 | 0.96 | 25.2 | 161 | 微溶于水 |
环己烯 | 0.81 | -103 | 83 | 不溶于水 |
85% H3PO4 | 1.68 | 42.35 | 213(失水) | 易溶于水 |
已知:环己醇能与水形成二元共沸物(含水80%),其沸点为97.8℃
实验原理:
(1)该实验的反应原理与实验室制乙烯相似,请用化学方程式表示______。
(2)该反应有副反应发生(产物为 ),反应的方程式为____。
),反应的方程式为____。
II.制备粗产品:
(3)在圆底烧瓶中加入20mL(9.6g)环己醇、10mL 85% H3PO4几粒碎瓷片,用电热包均匀缓慢加热。温度计的温度不应超过90℃,原因是____;85% H3PO4在反应中的作用是____;碎瓷片的作用是_____。
Ⅲ.粗产品提纯
(4)从分液漏斗中分离出来的环己烯还要转移到蒸馏烧瓶中,并加入少量的无水氯化钙进一步蒸馏,此时温度计下端的水银球应插在蒸馏烧瓶的_____位置,温度计显示的温度应为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以甲醇为原料制取高纯H2具有重要的应用价值。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:![]() H=+49kJmol-1
H=+49kJmol-1
副反应:![]() H=+41kJmol-1
H=+41kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是______________。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是__________。
对甲醇水蒸气重整制氢的好处是__________。
③某温度下,将n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为________________(忽略副反应,用含P1、P2的式子表示)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:![]() H=+203kJmol-1
H=+203kJmol-1
①该反应逆反应速率表达式为:v逆=k·c(CO)·c3(H2),k为速率常数,在某温度下测得实验数据如下表:
c(CO)/mol·L-1 | c(H2)/mol·L-1 | v逆/mol·L-1·min-1 |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为_________L3·mol-3·min-1。
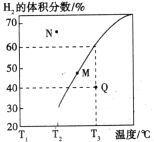
②在体积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度关系如图所示:N点v正____________M点v逆(填“大于”或“小于”);Q点对应温度下该反应的平衡常数K=_______________mol2·L-2。平衡后再向容器中加入1molCH4和1molCO,平衡向_____________方向移动(填“正反应”或“逆反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究NaHSO3溶液分别与CuCl2、CuSO4溶液的反应。

已知:①![]() (深蓝色溶液)
(深蓝色溶液)
②![]()
回答下列问题:
(1)实验Ⅰ产生的无色气体为SO2。用蘸有碘水的淀粉试纸接近试管口,观察到_________________________,反应的离子方程式为______________________。
(2)对实验Ⅰ产生SO2的原因进行分析,提出两种假设:
①Cu2+水解使溶液中c(H+)增大;
②Cl-存在时,Cu2+与![]() 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
实验证明,①不合理,实验证据是____________________;②合理,实验Ⅰ反应的离子方程式有_________________________、H++![]() =SO2↑+H2O。
=SO2↑+H2O。
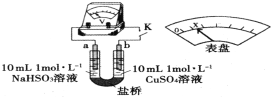
(3)通过分析实验Ⅰ、Ⅱ,可知:Cl-增强了Cu2+的氧化性。下述实验证实了此结论。实验方案:闭合K,电压表的指针偏转至“x”处;向U形管___________(补全实验操作及现象)。装置中,盐桥的作用是______________________________(答出两条即可)。
(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和![]() 。设计实验,证明红色沉淀中含有Cu+__________________。
。设计实验,证明红色沉淀中含有Cu+__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A. H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH﹣+H++![]() →BaSO4↓+H2O
→BaSO4↓+H2O
B. 将Na投入到CuSO4溶液中:2Na+Cu2+===2Na++Cu↓
C. 大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO﹣+CO2↑+H2O
D. 将Cl2通入水中:Cl2+H2O===2H++Cl﹣+ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
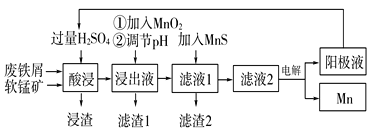
【题目】下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为MnO2)制备硫酸锰及电解其溶液制锰的工艺流程图:
已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等杂质金属离子;
②生成氢氧化物的pH见下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
请回答下列问题:
(1)“酸浸”前将原料粉碎的目的是____。
(2)流程图中“①加入MnO2”的作用____,MnO2还可以用其他试剂____(填化学式)代替。
(3)流程图中“②调节pH”可以除去某种金属离子,应将溶液pH调节控制的范围是___~7.6。上述流程中,能循环使用的一种物质是___(填化学式)。
(4)向滤液Ⅰ中加入MnS的作用是除去Co2+、Ni2+等离子,其中可以发生反应为MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)等。当该反应完全后,滤液2中的Mn2+与Ni2+的物质的量浓度之比是___[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)在适当条件下,在MnSO4、H2SO4和H2O为体系的电解液中电解也可获得MnO2,其阳极电极反应式为____。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com