
����Ŀ��(1)�Լ״�Ϊԭ����ȡ�ߴ�H2������Ҫ��Ӧ�ü�ֵ���״�ˮ��������������Ҫ��������������Ӧ��
����Ӧ��![]() H=+49kJmol-1
H=+49kJmol-1
����Ӧ��![]() H=+41kJmol-1
H=+41kJmol-1
���״������ڴ����������ѽ�ɵõ�H2��CO����÷�Ӧ���Ȼ�ѧ����ʽΪ_________________�����ܼӿ췴Ӧ�����������CH3OHƽ��ת���ʵ�һ�ִ�ʩ��______________��
�������ʵ�����ˮ����![]() �Լ״�ˮ������������ĺô���__________��
�Լ״�ˮ������������ĺô���__________��
��ij�¶��£���n(H2O)��n(CH3OH)=1��1��ԭ������������ܱ������У���ʼѹǿΪP1����Ӧ��ƽ��ʱ��ѹǿΪP2����ƽ��ʱ�״���ת����Ϊ________________(���Ը���Ӧ���ú�P1��P2��ʽ�ӱ�ʾ)��
(2)��ҵ����CH4��ˮ������һ����������ȡH2��ԭ��Ϊ��![]() H=+203kJmol-1
H=+203kJmol-1
���÷�Ӧ�淴Ӧ���ʱ���ʽΪ��v��=k��c(CO)��c3(H2)��kΪ���ʳ�������ij�¶��²��ʵ���������±���
c(CO)/mol��L��1 | c(H2)/mol��L��1 | v��/mol��L��1��min��1 |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
���������ݿɵø��¶��£��÷�Ӧ���淴Ӧ���ʳ���kΪ_________L3��mol��3��min��1��
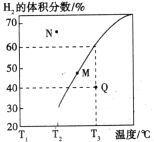
�������Ϊ3L���ܱ�������ͨ�����ʵ�����Ϊ3mol��CH4��ˮ��������һ�������·���������Ӧ�����ƽ��ʱH2������������¶ȹ�ϵ��ͼ��ʾ��N��v��____________M��v��(��������������С����)��Q���Ӧ�¶��¸÷�Ӧ��ƽ�ⳣ��K=_______________mol2��L��2��ƽ������������м���1molCH4��1molCO��ƽ����_____________�����ƶ�(��������Ӧ�������淴Ӧ��)��
���𰸡�![]() H =+90 kJ��mol��1 ���� ��״��������ʣ�����������CO�����ɻ����Ƹ���Ӧ����
H =+90 kJ��mol��1 ���� ��״��������ʣ�����������CO�����ɻ����Ƹ���Ӧ���� ![]() 1.2��104 С�� 48 ����Ӧ
1.2��104 С�� 48 ����Ӧ
��������
������֪��������Ӧ�����ݸ�˹���ɣ�������״������ڴ����������ѽ�����H2��CO���Ȼ�ѧ����ʽ������Ũ�ȱ仯���Ȼ�ѧ����ʽ![]() H =+90 kJ��mol��1�����ʺ�CH3OHƽ��ת���ʵ�Ӱ�죬�Ӷ�ȷ���ı�ķ�Ӧ�������ʵ�����ˮ����
H =+90 kJ��mol��1�����ʺ�CH3OHƽ��ת���ʵ�Ӱ�죬�Ӷ�ȷ���ı�ķ�Ӧ�������ʵ�����ˮ����![]() ������������Ӧ�ĵIJ��ʣ��ֿ��ǶԸ���Ӧ�����Ӱ�죬�Ӷ��ó����������ĺô�������n(H2O)��n(CH3OH)=1��1����������ʽ������״������ʵ����ı仯�����Ӷ�ƽ��ʱ�״���ת���ʡ����ñ������ݼ���ʽv��=k��c(CO)��c3(H2)���c2���ٴ��빫ʽ���k��������֪�����������Ϊ3L���ܱ�������ͨ�����ʵ�����Ϊ3mol��CH4��ˮ����������������ʽ������H2��ƽ���������Ϊ60%�����CH4�����ʵ���Ũ�ȣ��Ӷ����Q���Ӧ�¶��¸÷�Ӧ��ƽ�ⳣ��K��ƽ������������м���1molCH4��1molCO�����Ũ���̣���ƽ�ⳣ�����бȽϣ��Ӷ�ȷ��ƽ���ƶ��ķ���
������������Ӧ�ĵIJ��ʣ��ֿ��ǶԸ���Ӧ�����Ӱ�죬�Ӷ��ó����������ĺô�������n(H2O)��n(CH3OH)=1��1����������ʽ������״������ʵ����ı仯�����Ӷ�ƽ��ʱ�״���ת���ʡ����ñ������ݼ���ʽv��=k��c(CO)��c3(H2)���c2���ٴ��빫ʽ���k��������֪�����������Ϊ3L���ܱ�������ͨ�����ʵ�����Ϊ3mol��CH4��ˮ����������������ʽ������H2��ƽ���������Ϊ60%�����CH4�����ʵ���Ũ�ȣ��Ӷ����Q���Ӧ�¶��¸÷�Ӧ��ƽ�ⳣ��K��ƽ������������м���1molCH4��1molCO�����Ũ���̣���ƽ�ⳣ�����бȽϣ��Ӷ�ȷ��ƽ���ƶ��ķ���
��
(1)����Ӧ��![]() H=+49kJmol- ��
H=+49kJmol- ��
����Ӧ��![]() H=+41kJmol-1 ��
H=+41kJmol-1 ��
�����ø�˹���ɣ�����+�ڵã��״������ڴ����������ѽ�ɵõ�H2��CO����÷�Ӧ���Ȼ�ѧ����ʽΪ![]() H =+90 kJ��mol��1���ӿ췴Ӧ����������Ũ�ȡ�ѹǿ�������¶ȡ���������ȣ�������Ũ�ȡ�ѹǿ������������������CH3OHƽ��ת���ʣ����Լ��ܼӿ췴Ӧ�����������CH3OHƽ��ת���ʵ�һ�ִ�ʩ�����¡���Ϊ��
H =+90 kJ��mol��1���ӿ췴Ӧ����������Ũ�ȡ�ѹǿ�������¶ȡ���������ȣ�������Ũ�ȡ�ѹǿ������������������CH3OHƽ��ת���ʣ����Լ��ܼӿ췴Ӧ�����������CH3OHƽ��ת���ʵ�һ�ִ�ʩ�����¡���Ϊ��![]() H =+90 kJ��mol��1�����£�
H =+90 kJ��mol��1�����£�
���ʵ�����ˮ����![]() ������������Ӧ��CH3OH��ƽ��ת���ʣ�ͬʱ�Ը���Ӧ���������ã����ԶԼ״�ˮ������������ĺô�����״��������ʣ�����������CO�����ɻ����Ƹ���Ӧ��������Ϊ����״��������ʣ�����������CO�����ɻ����Ƹ���Ӧ������
������������Ӧ��CH3OH��ƽ��ת���ʣ�ͬʱ�Ը���Ӧ���������ã����ԶԼ״�ˮ������������ĺô�����״��������ʣ�����������CO�����ɻ����Ƹ���Ӧ��������Ϊ����״��������ʣ�����������CO�����ɻ����Ƹ���Ӧ������
��ij�¶��£���n(H2O)��n(CH3OH)=1��1��ԭ������������ܱ������У���ʱ��n(H2O)=n(CH3OH)=1mol���״������ʵ����ı仯��Ϊx��������������ʽ��
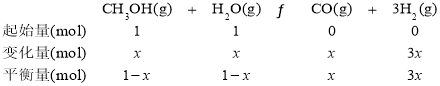
![]() ��x=
��x=![]() mol����ƽ��ʱ�״���ת����Ϊ
mol����ƽ��ʱ�״���ת����Ϊ![]() =
=![]() ������
������![]() ��
��
(2)������v���ɵã�![]()
�ڴ�ͼ�п��Կ�����M��ʱ�¶ȸ���N�㣬����N��v��С��M��v����Q���Ӧ�¶�ΪT3����ʱH2��ƽ���������Ϊ60%����μӷ�Ӧ��CH4�����ʵ���Ũ��Ϊy����������ݿɽ�����������ʽ��
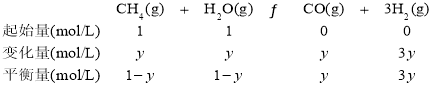
![]() ��y=
��y=![]() mol/L���÷�Ӧ��ƽ�ⳣ��K=
mol/L���÷�Ӧ��ƽ�ⳣ��K=![]() mol2��L��2=48mol2��L��2��ƽ������������м���1molCH4��1molCO����ʱŨ����Q=
mol2��L��2=48mol2��L��2��ƽ������������м���1molCH4��1molCO����ʱŨ����Q=![]() mol2��L��2=36 mol2��L��2<48 mol2��L��2������ƽ��������Ӧ�����ƶ�����Ϊ��С�ڣ�48������Ӧ��
mol2��L��2=36 mol2��L��2<48 mol2��L��2������ƽ��������Ӧ�����ƶ�����Ϊ��С�ڣ�48������Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
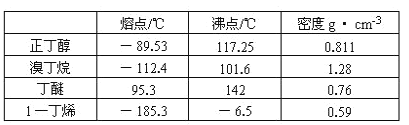
����Ŀ��ʵ�������ü������������廯�ƺ�Ũ����Ļ����ķ����Ʊ�1-�嶡�飬������ϩ���Ѻ���Ȳ������ɣ���Ӧ������Ӧ������������õ�1-�嶡�顣��֪�й����ʵ��������£�

��1������1���嶡��ķ�Ӧ��ѧ����ʽΪ_____��
��2����Ӧ�����ڷ�������Ӧ�����ɸ�����ϩ���ѵķ�Ӧ��������Ϊ_____��_____��
��3������1���嶡��ķ�Ӧװ��Ӧѡ��ͼ�е�______(�����)����Ӧ����ʱ���¶�t1Ӧ������_____100��(���� ��������)��
��4����Ӧ��������Ӧ������� l���嶡����������Ӧѡ�õ�װ����_____���ò���Ӧ���Ƶ��¶�t2��Χ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ NO �ķ�ӦΪ![]() ��
��
(1)![]() �ĵ���ʽΪ________��
�ĵ���ʽΪ________��
(2)��֪���ֹ��ۼ��ļ�������:
���ۼ� | H-H |
| N-O | H-O |
����/( | 436 | 946 |
| 464 |
�����������ݼ��㣬NO�ļ���![]() =___________��
=___________��
(3)![]() �ķ�Ӧ���ʱ���ʽΪ
�ķ�Ӧ���ʱ���ʽΪ![]() (
(![]() Ϊ����Ӧ���ʳ�����ֻ���¶��йء�
Ϊ����Ӧ���ʳ�����ֻ���¶��йء�![]() ��
��![]() Ϊ��Ӧ������ȡ���������)��
Ϊ��Ӧ������ȡ���������)��
Ϊ��̽��һ���¶��� NO��![]() ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬���ʵ���������£�
��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬���ʵ���������£�
��� |
|
|
|
�� | 0.10 | 0.10 | 0.414 |
�� | 0.10 | 0.20 | 0.828 |
�� | 0.30 | 0.10 | 3.726 |
��![]() ��
��![]() =____��
=____��![]() =______��
=______��
�ھ��о����������������Ӧ���������У�![]() ��
��![]() ��
��
��ѧ�ܷ�Ӧ�ɽ�����һ����Ӧ������
������Ӧ�У�(a)��Ӧ������(a)����Ӧ���________(����ڡ���С�ڡ����ڡ�)(b)����Ӧ��ܡ�
��1889�꣬��仯ѧ�Ұ�������˹����ʵ������������¶��뷴Ӧ���ʳ�����ϵ�ľ��鹫ʽ��![]() [
[![]() Ϊ��Ӧ���ʳ�����
Ϊ��Ӧ���ʳ�����![]() Ϊ����������
Ϊ����������![]() Ϊ��Ȼ�����ĵ�����
Ϊ��Ȼ�����ĵ�����![]() Ϊ����Ħ��������
Ϊ����Ħ��������![]() Ϊ�������¶ȣ�
Ϊ�������¶ȣ�![]() Ϊ���
���![]() ]��
]��![]() ��Ӧ�ﵽƽ��������¶ȣ�����Ӧ���ʳ�������ı���_____(����ڡ���С�ڡ����ڡ�)�淴Ӧ���ʳ�������ı�����
��Ӧ�ﵽƽ��������¶ȣ�����Ӧ���ʳ�������ı���_____(����ڡ���С�ڡ����ڡ�)�淴Ӧ���ʳ�������ı�����
(4)һ���¶��£���2 L�����ܱ������г���2 mol NO(g)��![]() ����������Ӧ���������ѹǿ����ʱ��仯��ϵ��ͼ��ʾ��
����������Ӧ���������ѹǿ����ʱ��仯��ϵ��ͼ��ʾ��
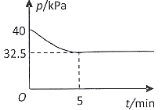
��05 min ��![]() ��ƽ������
��ƽ������ ![]() =___________________
=___________________![]() ��
��
�ڸ��¶��£�������Ӧ��ƽ�ⳣ��![]() =________________
=________________![]() ��
��
�������������䣬��10minʱ��Ӧ��ϵ���ٳ���1mol NO��![]() ���ﵽ��ƽ��ʱNO��ƽ��ת���� ________________(�������С�����䡱)��
���ﵽ��ƽ��ʱNO��ƽ��ת���� ________________(�������С�����䡱)��
(5)��ҵ�ϣ����Բ��õ绯ѧ��������NO���Զ��Բ���Ϊ�缫�����������ҺΪ�������Һ������![]() ����ⷴӦΪ
����ⷴӦΪ![]() ���������У������ĵ缫��ӦʽΪ_______________________��
���������У������ĵ缫��ӦʽΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Ҵӷ϶�ӰҺ�л���Ag��Br2����Ҫ����Ϊ����϶�ӰҺ�м���Na2S��Һ���������ӣ����ˡ�ϴ�ӡ��������Ag2S��ȡ����Ag����ȡCl2����Cl2ͨ����Һ������Br�������ñ���ȡ��Һ�����в���ʵ�������װ����ͼ��ʾ������������ȷ����
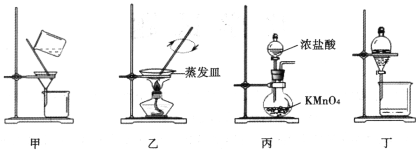
A.��װ�ü���Ag2Sʱ���ò��������Ͻ���
B.��װ������ͨ����и�������Ag2S��ȡAg
C.��װ�ñ��Ʊ�Cl2������KMnO4Ҳ����MnO2����
D.��װ�ö���Һʱ����Һ©�����ӣ��ٴ�������ʹ�²�Һ��ӷ�Һ©���¶˷ų�������Һ�����������Ͽ����м��ɹر�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ�������εij����ܽ�ƽ��������ͼ��ʾ����֪pMΪ������Ũ�ȵĸ�������pRΪ������Ũ�ȵĸ�����������˵����ȷ����( )
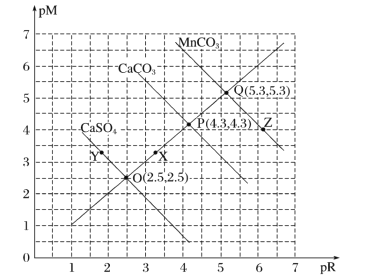
A.Y�㣺c(Ca2+)>c(SO42-)��Z�㣺c(CO32-)>c(Mn2+)
B.�ܶȻ���Ksp(MnCO3)��Ksp(CaCO3)��Ksp(CaSO4)
C.X���Ӧ��CaCO3��ҺΪ��������Һ�����Լ����ܽ�CaCO3
D.T��ʱ��CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)��ƽ�ⳣ��K��������Ϊ103
CaCO3(s)+SO42-(aq)��ƽ�ⳣ��K��������Ϊ103
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£������Ϊ![]() ���ܱ������У����ڹ�ϵ
���ܱ������У����ڹ�ϵ![]() ����Ӧ�������������ʵ�����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
����Ӧ�������������ʵ�����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A. ![]()
B. ���¶��£���Ӧ��ƽ�ⳣ��Ϊ![]()
C. ƽ��ʱ��������ƽ��Ħ��������![]()
D. ![]() ʱ�̣������¶Ȳ��䣬�ٳ���
ʱ�̣������¶Ȳ��䣬�ٳ���![]() �����´ﵽƽ��ʱ��
�����´ﵽƽ��ʱ��![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µ�2L�ܱ������У�������Ӧ��X(g)+Y(g)![]() 2Z(g)���ﵽƽ��ʱ�������ʵ�ƽ��Ũ��Ϊ��c(X)=0.8mol/L��c(Y)=0.1mol/L��c (Z)=1.6mol/L������a��b��c�ֱ��ʾX��Y��Z����ʼ�����ʵ������ش��������⣺
2Z(g)���ﵽƽ��ʱ�������ʵ�ƽ��Ũ��Ϊ��c(X)=0.8mol/L��c(Y)=0.1mol/L��c (Z)=1.6mol/L������a��b��c�ֱ��ʾX��Y��Z����ʼ�����ʵ������ش��������⣺
��1�����ں��º��������½��з�ӦX(g)+Y(g)![]() 2Z(g)�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_____
2Z(g)�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_____
A����λʱ��������n molX��ͬʱ����2nmolZ
B���ܱ��������ܶȲ��ٸı��״̬
C����X��Y��Z�����ʵ���Ũ�ȱ仯��ʾ��Ӧ���ʵı�Ϊ1��1��2��״̬
D����Ӧ������Y�����ʵ����������ٸı��״̬
E���ܱ�������ѹǿ���ٸı��״̬
F����������ƽ����Է����������ٸı��״̬
��2��a��bӦ����Ĺ�ϵ��_________��
��3��a��ȡֵ��Χ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�����ö�������(CeO2)��̫���������½�H2O��CO2ת���H2��CO����������£�mCeO2 (m��x)CeO2��xCe+xO2��(m-x)CeO2��xCe+xH2O+xCO2
(m��x)CeO2��xCe+xO2��(m-x)CeO2��xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO

����˵������ȷ����(�� ��)
A.�ù�����CeO2û������B.�ù���ʵ����̫������ѧ�ܵ�ת��
C.ͼ����H1=��H2+��H3D.H2(g)+O2(g)=H2O(g)�ķ�Ӧ�ȴ�����H3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����CO��N2O��Fe+�����·�����Ӧ�������仯����Ӧ������ͼ��ʾ��������Ӧ�քeΪ����N2O+Fe+=N2+FeO (��������FeO++CO=CO2+Fe+ (�죩������˵����ȷ����
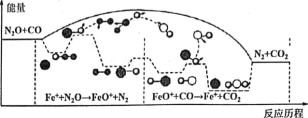
A. ��Ӧ����������ԭ��Ӧ����Ӧ���Ƿ�������ԭ��Ӧ
B. ������Ӧ��Ϊ���ȷ�Ӧ���ܷ�Ӧ�Ļ�ѧ��Ӧ�����ɷ�Ӧ�ھ���
C. Fe+ʹ��Ӧ�Ļ�ܼ�С��FeO+���м����
D. ��ת��lmol���ӣ�������II.2LN2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com