
【题目】一定温度下,在体积为![]() 的密闭容器中,存在关系
的密闭容器中,存在关系![]() ,反应物和生成物的物质的量随时间变化的关系如图所示。下列说法正确的是( )
,反应物和生成物的物质的量随时间变化的关系如图所示。下列说法正确的是( )

A. ![]()
B. 该温度下,反应的平衡常数为![]()
C. 平衡时混合气体的平均摩尔质量是![]()
D. ![]() 时刻,保持温度不变,再充入
时刻,保持温度不变,再充入![]() ,重新达到平衡时,
,重新达到平衡时,![]() 增大
增大
【答案】D
【解析】
A.由图可知,反应消耗了3molH2O,生成了1mol(H2O)x,根据原子守恒可知x=3,故A错误;
B.由上述分析可知x=3,在该温度下,平衡时c[(H2O)3]=1mol÷2L=0.5mol/L,c(H2O)=2mol÷2L=1mol/L,反应的平衡常数:K=c[(H2O)3]/c3((H2O)=![]() =0.5L2/mol2,故B错误;
=0.5L2/mol2,故B错误;
C.根据质量守恒,平衡时混合气体质量与初始时投入的5molH2O的质量相同,即90g,平衡时混合气体物质的量为3mol,那么混合气体的平均摩尔质量为30g/mol,故C错误;
D.t1时刻反应已经达到平衡,此时保持温度不变充入1molH2O(g),由于容器是密闭的,相当于增大了压强,根据勒夏特列原理,平衡会朝压强减小的方向即正方向移动,更倾向于消耗反应物,生成产物,所以平衡时的![]() 将增大,故D正确;
将增大,故D正确;
本题答案为D。


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1
B. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
C. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1
D. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )

A. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方 程式为:MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类依据正确的是( )
物质类别 | 分类依据 | |
A | 酸 | 电离时能否产生氢离子 |
B | 碱性氧化物 | 是否属于金属氧化物 |
C | 胶体 | 能否发生丁达尔现象 |
D | 强电解质 | 在水溶液中或熔化状态下能否完全电离 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为![]() 的密闭容器内,物质
的密闭容器内,物质![]() 在
在![]() ℃时发生反应,其反应物和生成物的物质的量随时间
℃时发生反应,其反应物和生成物的物质的量随时间![]() 的变化关系如图,下列叙述不正确的是( )
的变化关系如图,下列叙述不正确的是( )
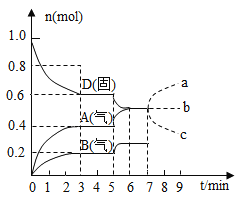
A. 若在第7分钟时增加![]() 的物质的量,则表示
的物质的量,则表示![]() 的物质的量变化正确的是a曲线
的物质的量变化正确的是a曲线
B. 该反应的化学方程式为![]() ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为![]()
C. 已知反应的![]() ,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 从反应开始到第一次达到平衡时,![]() 物质的平均反应速率为
物质的平均反应速率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是

选项 | X | Y |
A. | MgSO4 | CuSO4 |
B. | AgNO3 | CuSO4 |
C. | FeSO4 | Al2(SO4)3 |
D. | CuSO4 | AgNO3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.σ键一定比π键强度大
B.CO2溶于水和干冰升华都只有分子间作用力改变
C.缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体
D.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1。则下列热化学方程式中正确的是
A. ![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l) ΔH=-267 kJ·mol-1
N2(g)+H2O(l) ΔH=-267 kJ·mol-1
B. ![]() N2H4(g)+
N2H4(g)+![]() O2(g) =
O2(g) = ![]() N2(g)+H2O(g) ΔH=+267 kJ·mol-1
N2(g)+H2O(g) ΔH=+267 kJ·mol-1
C. 2N2H4(g)+2O2(g)=2N2(g)+4H2O(g) ΔH=-1068 kJ·mol-1
D. N2(g)+2H2O(l) = N2H4(g)+O2(g) ΔH=+534 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com