
【题目】氢气还原 NO 的反应为![]() 。
。
(1)![]() 的电子式为________。
的电子式为________。
(2)已知几种共价键的键能如下:
共价键 | H-H |
| N-O | H-O |
键能/( | 436 | 946 |
| 464 |
根据上述数据计算,NO的键能![]() =___________。
=___________。
(3)![]() 的反应速率表达式为
的反应速率表达式为![]() (
(![]() 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。![]() 和
和![]() 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。
为了探究一定温度下 NO、![]() 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:
序号 |
|
|
|
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.10 | 0.20 | 0.828 |
Ⅲ | 0.30 | 0.10 | 3.726 |
①![]() 中,
中,![]() =____,
=____,![]() =______。
=______。
②经研究,有人提出上述反应分两步进行:![]() ;
;![]() 。
。
化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能________(填“大于”“小于”或“等于”)(b)正反应活化能。
③1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式:![]() [
[![]() 为反应速率常数,
为反应速率常数,![]() 为比例常数,
为比例常数,![]() 为自然对数的底数,
为自然对数的底数,![]() 为气体摩尔常数,
为气体摩尔常数,![]() 为开尔文温度,
为开尔文温度,![]() 为活化能
为活化能![]() ]。
]。![]() 反应达到平衡后,升高温度,正反应速率常数增大的倍数_____(填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
反应达到平衡后,升高温度,正反应速率常数增大的倍数_____(填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
(4)一定温度下,在2 L恒容密闭容器中充入2 mol NO(g)、![]() 发生上述反应,混合气体压强随着时间变化关系如图所示。
发生上述反应,混合气体压强随着时间变化关系如图所示。
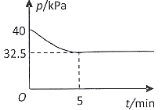
①05 min 内![]() 的平均速率
的平均速率 ![]() =___________________
=___________________![]() 。
。
②该温度下,上述反应的平衡常数![]() =________________
=________________![]() 。
。
③其他条件不变,在10min时向反应体系中再充入1mol NO、![]() ,达到新平衡时NO的平衡转化率 ________________(填“增大”“减小”或“不变”)。
,达到新平衡时NO的平衡转化率 ________________(填“增大”“减小”或“不变”)。
(5)工业上,可以采用电化学方法处理NO。以惰性材料为电极,以硝酸铵溶液为电解质溶液并补充![]() ,电解反应为
,电解反应为![]() 。电解过程中,阳极的电极反应式为_______________________。
。电解过程中,阳极的电极反应式为_______________________。
【答案】![]() 633 1 2 大于 小于 0.075 54 增大
633 1 2 大于 小于 0.075 54 增大 ![]()
【解析】
(1)氧原子最外层6个电子,用2个电子与氢形成2个共价键,达8电子稳定结构。
(2)根据△H=反应物键能之和-生成物键能之和计算;
(3)①![]() 中,由①②组数据代入公式求出m,同理由①③组数据求出n;
中,由①②组数据代入公式求出m,同理由①③组数据求出n;
(4)利用三段式进行分析,根据速率公式、平衡公式、浓度商公式计算;
(5)电解过程中,NO在阳极发生氧化反应生成NO![]() 。
。
(1)氧原子最外层6个电子,用2个电子与氢形成2个共价键,达8电子稳定结构,H2O的电子式为![]() 。故答案为:
。故答案为:![]() ;
;
(2)氢气还原 NO 的反应为![]() ,△H=2a
,△H=2a![]() +2×436
+2×436![]() -946
-946![]() -4×464
-4×464![]() =-664.0
=-664.0![]() ,根据上述数据计算,NO的键能
,根据上述数据计算,NO的键能![]() =633。故答案为:633;
=633。故答案为:633;
(3)①![]() 中,由①②组数据可知
中,由①②组数据可知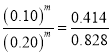 ,则m=1,由①③组数据可知
,则m=1,由①③组数据可知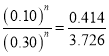 ,
,![]() =2。故答案为:1;2;
=2。故答案为:1;2;
②化学总反应由较慢的一步反应决定,反应慢的一步活化能较大。(a)反应较慢,(a)正反应活化能大于(b)正反应活化能。故答案为:大于;
③![]() 是正向放热的反应,反应达到平衡后,根据
是正向放热的反应,反应达到平衡后,根据![]() ,升高温度,K值变小,平衡逆向移动,正反应速率常数增大的倍数小于逆反应速率常数增大的倍数。故答案为:小于;
,升高温度,K值变小,平衡逆向移动,正反应速率常数增大的倍数小于逆反应速率常数增大的倍数。故答案为:小于;
(4)利用三段式进行
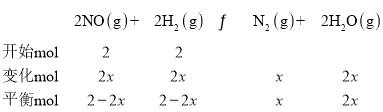
![]() ,解得:x=0.75
,解得:x=0.75
①05 min 内![]() 的平均速率
的平均速率 ![]() =
=![]() =0.075
=0.075![]() 。故答案为:0.075;
。故答案为:0.075;
②该温度下,上述反应的平衡常数K=![]() =54
=54![]() 。故答案为:54;
。故答案为:54;
③其他条件不变,在10min时向反应体系中再充入1mol NO、![]() ,Qc=
,Qc=![]() <K,平衡正向移动,达到新平衡时NO的平衡转化率增大。故答案为:增大;
<K,平衡正向移动,达到新平衡时NO的平衡转化率增大。故答案为:增大;
(5)电解过程中,NO在阳极发生氧化反应生成NO![]() ,阳极的电极反应式为
,阳极的电极反应式为![]() 。故答案为:
。故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】硫及其化合物有如下转化关系
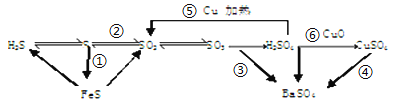
(1)发生氧化还原反应的是___________(填序号)
(2)写出(5)的反应方程式____________,说明浓硫酸具有___________,制取CuSO4,__________方法最好(填序号);
(3)SO2是造成空气污染,形成酸雨的主要物质。SO2在水的存在下与氧气反应生成硫酸,反应方程式为_____________。验证二氧化硫的方法是_____________。
(4)某溶液中含有Cl-、SO42-,可能含有Na+、Fe2+或其中一种。
①验证Cl-、SO42-的方法是______________
A.先加BaCl2溶液,等沉淀后,再加AgNO3溶液
B.先加AgNO3溶液,等沉淀后,再加BaCl2溶液
C.先加Ba(NO3)2溶液,等沉淀后,再加AgNO3溶液
②验证Na+或Fe2+最简单的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,有下列五种溶液:
①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③0.1mol/LNH4HSO4
④0.1mol/LNH4HCO3 ⑤0.1mol/LNaHCO3
请根据要求填写下列空白:
(1)溶液①呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示)
(2)溶液⑤呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示)
(3)比较溶液①、③中c(NH4+)的大小关系是① ______ ③(填“>”、“<”或“=”)
(4)常温下,测得溶液②的pH=7,则CH3COO-的水解程度 ______ NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 K2FeO4 溶于水后,会水解生成多种微粒。下图是0.10 mol·L1 K2FeO4 溶液中各含铁微粒随溶液 pH 的变化图,纵坐标表示其个数百分含量,则下列说法不正确的是
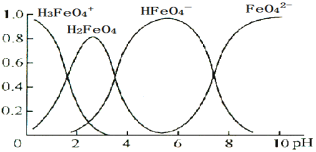
A.K2FeO4 溶于水呈碱性B.![]() 水解强于电离
水解强于电离
C.H2FeO4 既能和强碱反应又能和强酸反应D.0.10 mol·L1 的 K2FeO4 的 pH 近似等于 10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.由三种常见元素组成的化合物A,按如下流程进行实验。气体B、C、D均无色、无臭,B、D是纯净物;浓硫酸增重3.60g,碱石灰增重17.60g;溶液F焰色反应呈黄色。
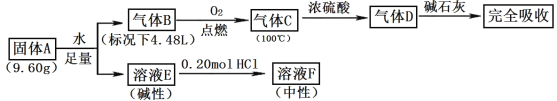
请回答:
(1)组成A的非金属元素是_____,气体B的结构简式_____。
(2)固体A与足量水反应的化学方程式是_____。
(3)一定条件下,气体D可能和FeO发生氧化还原反应,试写出一个可能的化学方程式_____。
Ⅱ.某兴趣小组为验证卤素单质的氧化性强弱,向NaBr溶液中通入一定量Cl2,将少量分液漏斗中溶液滴入试管中,取试管振荡,静止后观察现象。实验装置如图:
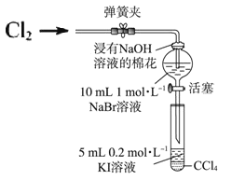
(4)说明氧化性 Br2>I2 的实验现象是_____。
(5)为了排除Cl2对溴置换碘实验的干扰,需确认分液漏斗中通入Cl2 未过量。试设计简单实验方案检____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的基本有机原料,在一定条件下其衍变关系如下图:
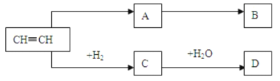
已知:B是一种塑料,75%的D溶液在医药上用作消毒剂。试回答下列问题:
(1)比乙炔多一个碳原子的同系物的结构简式是________________________。
(2).A物质的结构简式是________________________,A→B反应类型是______反应。
(3).写出以下各步反应的化学方程式:
乙炔→A:______________________________________________
乙炔→C:______________________________________________
C→D:_________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有相同温度和压强下的两种气体12C18O和14N2,若两种气体的质量相同,则两种气体所含的质子数之比为__________,若两种气体的原子数相等,则两种气体所含中子数之比_________,若两种气体的体积相同,则两种气体的密度之比为_________。
(2)10.8 g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为 ________。
(3)将10 mL1.00 mol/L Na2CO3溶液与10 mL1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为___________(忽略混合前后溶液体积的变化)。
(4)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是_________。
(5)在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以甲醇为原料制取高纯H2具有重要的应用价值。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:![]() H=+49kJmol-1
H=+49kJmol-1
副反应:![]() H=+41kJmol-1
H=+41kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是______________。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是__________。
对甲醇水蒸气重整制氢的好处是__________。
③某温度下,将n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为________________(忽略副反应,用含P1、P2的式子表示)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:![]() H=+203kJmol-1
H=+203kJmol-1
①该反应逆反应速率表达式为:v逆=k·c(CO)·c3(H2),k为速率常数,在某温度下测得实验数据如下表:
c(CO)/mol·L-1 | c(H2)/mol·L-1 | v逆/mol·L-1·min-1 |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为_________L3·mol-3·min-1。
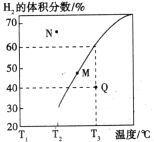
②在体积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度关系如图所示:N点v正____________M点v逆(填“大于”或“小于”);Q点对应温度下该反应的平衡常数K=_______________mol2·L-2。平衡后再向容器中加入1molCH4和1molCO,平衡向_____________方向移动(填“正反应”或“逆反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示(SO![]() 、OH表示自由基)。设阿伏加德罗常数的值为NA。下列叙述错误的是( )
、OH表示自由基)。设阿伏加德罗常数的值为NA。下列叙述错误的是( )

A.过硫酸钠中-2价氧与-1价氧的个数比为3:1
B.若56gFe参加反应,共有1.5NA个S2O82被还原
C.碱性条件下硫酸根自由基发生反应的方程式为SO4-+OH-=SO42-+OH
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com