
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示(SO![]() 、OH表示自由基)。设阿伏加德罗常数的值为NA。下列叙述错误的是( )
、OH表示自由基)。设阿伏加德罗常数的值为NA。下列叙述错误的是( )

A.过硫酸钠中-2价氧与-1价氧的个数比为3:1
B.若56gFe参加反应,共有1.5NA个S2O82被还原
C.碱性条件下硫酸根自由基发生反应的方程式为SO4-+OH-=SO42-+OH
D.pH越小,越有利于去除废水中的正五价砷
【答案】BD
【解析】
A.过硫酸钠中正负化合价之和为零,S为+6价,Na为+1价,正价之和=(+6)×2+(+1)×2=14,负价之和为-14,若-2价氧与-1价氧的个数比为3:1,即-2价氧为6个,-1价氧的个数为2个,负价之和为(-2)×6+(-1)×2=-14,故A正确;
B.56gFe为1mol,根据图示可知,1molS2O82和1molFe反应生成2molSO42和1molFe2+,该过程转移2mol电子,但是Fe2+还要与S2O82反应变成Fe3+和自由基,根据图示,形成的沉淀中即含有二价铁离子,又含有三价铁离子,即第一步反应中的二价铁没有被完全氧化为三价铁离子,因此1mol铁参加反应消耗小于1.5mol S2O82,共有少于1.5NA个S2O82被还原,故B错误;
C.结合图示可知,碱性条件下,SO4发生反应的方程式为:SO4+OH═SO42+OH,故C正确;
D.根据图示可知,最后是碱性条件下,铁离子和亚铁离子转化为氢氧化亚铁和氢氧化铁,正五价砷离子转变为沉淀,二者共同以沉淀形式析出的,则溶液的碱性越强越有利于析出,即pH越大越有利于去除废水中的正五价砷,故D错误;
答案选BD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氢气还原 NO 的反应为![]() 。
。
(1)![]() 的电子式为________。
的电子式为________。
(2)已知几种共价键的键能如下:
共价键 | H-H |
| N-O | H-O |
键能/( | 436 | 946 |
| 464 |
根据上述数据计算,NO的键能![]() =___________。
=___________。
(3)![]() 的反应速率表达式为
的反应速率表达式为![]() (
(![]() 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。![]() 和
和![]() 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。
为了探究一定温度下 NO、![]() 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:
序号 |
|
|
|
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.10 | 0.20 | 0.828 |
Ⅲ | 0.30 | 0.10 | 3.726 |
①![]() 中,
中,![]() =____,
=____,![]() =______。
=______。
②经研究,有人提出上述反应分两步进行:![]() ;
;![]() 。
。
化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能________(填“大于”“小于”或“等于”)(b)正反应活化能。
③1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式:![]() [
[![]() 为反应速率常数,
为反应速率常数,![]() 为比例常数,
为比例常数,![]() 为自然对数的底数,
为自然对数的底数,![]() 为气体摩尔常数,
为气体摩尔常数,![]() 为开尔文温度,
为开尔文温度,![]() 为活化能
为活化能![]() ]。
]。![]() 反应达到平衡后,升高温度,正反应速率常数增大的倍数_____(填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
反应达到平衡后,升高温度,正反应速率常数增大的倍数_____(填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
(4)一定温度下,在2 L恒容密闭容器中充入2 mol NO(g)、![]() 发生上述反应,混合气体压强随着时间变化关系如图所示。
发生上述反应,混合气体压强随着时间变化关系如图所示。
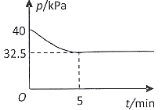
①05 min 内![]() 的平均速率
的平均速率 ![]() =___________________
=___________________![]() 。
。
②该温度下,上述反应的平衡常数![]() =________________
=________________![]() 。
。
③其他条件不变,在10min时向反应体系中再充入1mol NO、![]() ,达到新平衡时NO的平衡转化率 ________________(填“增大”“减小”或“不变”)。
,达到新平衡时NO的平衡转化率 ________________(填“增大”“减小”或“不变”)。
(5)工业上,可以采用电化学方法处理NO。以惰性材料为电极,以硝酸铵溶液为电解质溶液并补充![]() ,电解反应为
,电解反应为![]() 。电解过程中,阳极的电极反应式为_______________________。
。电解过程中,阳极的电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的2L密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g),达到平衡时,各物质的平衡浓度为:c(X)=0.8mol/L;c(Y)=0.1mol/L;c (Z)=1.6mol/L。若用a、b、c分别表示X、Y、Z的起始的物质的量,回答下列问题:
2Z(g),达到平衡时,各物质的平衡浓度为:c(X)=0.8mol/L;c(Y)=0.1mol/L;c (Z)=1.6mol/L。若用a、b、c分别表示X、Y、Z的起始的物质的量,回答下列问题:
(1)若在恒温恒容条件下进行反应X(g)+Y(g)![]() 2Z(g),可判断该反应达到化学平衡状态的是_____
2Z(g),可判断该反应达到化学平衡状态的是_____
A.单位时间内生成n molX的同时生成2nmolZ
B.密闭容器中密度不再改变的状态
C.用X、Y、Z的物质的量浓度变化表示反应速率的比为1∶1∶2的状态
D.反应容器中Y的物质的量分数不再改变的状态
E.密闭容器中压强不再改变的状态
F.混合气体的平均相对分子质量不再改变的状态
(2)a、b应满足的关系是_________。
(3)a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:mCeO2 (m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2
(m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO

下列说法不正确的是( )
A.该过程中CeO2没有消耗B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3D.H2(g)+O2(g)=H2O(g)的反应热大于ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如图工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
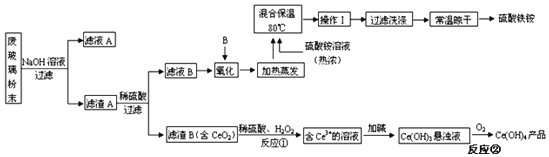
已知:①酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性。
②CeO2不溶于稀硫酸。
③硫酸铁铵[aFe2(SO4)3b(NH4)2SO4cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂B的是___(填序号)。
a.NaClO b.H2O2 c.KMnO4
(2)操作Ⅰ的名称是___,检验硫酸铁铵溶液中含有NH4+的方法是___。
(3)写出反应②的化学方程式___。
(4)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/LBa(NO3)2溶液100mL,恰好完全反应。通过计算,该硫酸铁铵的化学式为___(写出必要的计算步骤,否则不得分)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3CuO+2NH3![]() 3Cu+N2+3H2O。下列判断正确的是
3Cu+N2+3H2O。下列判断正确的是
A.N元素的化合价降低B.NH3被还原
C.消耗0.3 mol CuO转移0.6 NA个电子D.CuO是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是指导我们系统学习化学的重要工具。(答案都填写化学式)
(1)如图是铁元素在元素周期表中的有关信息。

写出Fe的原子结构示意图__,自然界中存在的54Fe和56Fe,它们互称为___。将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是__。通常证明某溶液中含Fe2+的化学方法是___。
下表是元素周期表的一部分:
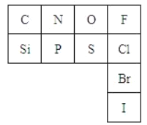
(2)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的__相同。处于同一列的N和P位于元素周期表的__族。
(3)通过元素周期表,我们可以知道:
①氮元素的最低化合价为_,其气态氢化物的结构式为__。
②与硅元素处于同一周期,两性金属元素是__,并写出其在元素周期表中的位置:第__周期,__族,该元素的最高价氧化物对应水化物的电离方程式为__。
③第三周期半径最大的金属元素__,该元素形成氢氧化物的电子式_,检验物质中是否含有该元素的方法是:__。
④在上表所列元素的最高价氧化物对应水化物中酸性最强的是__(写化学式)。该元素与硫元素相比,非金属性较强的元素是__(填元素符号),请写出证明该结论的一个实验事实:__。
⑤如图,将潮湿的Cl2单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是___。
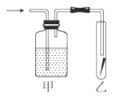
a.浓硫酸 b.NaOH溶液 c.KI溶液 d.饱和食盐水
⑥由于氢元素的化合价,有人提议还可以将其放在第__族,又有人提议可将它放在周期表中第IVA族,这样建议的原因是__。
⑦科学家通过对某些元素的化合价进行研究,寻找高效农药。这些元素往往位于元素周期表的__(选填序号)。
a.左下角区域 b.右上角区域 c.左上角区域 d.右下角区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO (慢):②FeO++CO=CO2+Fe+ (快)。下列说法正确的是
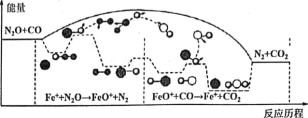
A. 反应①是氧化还原反应,反应②是非氧化还原反应
B. 两步反应均为放热反应,总反应的化学反应速率由反应②决定
C. Fe+使反应的活化能减小,FeO+是中间产物
D. 若转移lmol电子,则消耗II.2LN2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(![]() )元素在元素周期表中位于第
)元素在元素周期表中位于第![]() 族,其单质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是
族,其单质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是![]() 、含
、含![]() 等杂质)中提取单质碲,步骤如下:
等杂质)中提取单质碲,步骤如下:
①将铜阳极泥在空气中焙烧使碲转化为![]() ;
;
②用![]() 溶液碱浸;
溶液碱浸;
③以石墨为电极电解②所得溶液获得![]() 。
。
已知:![]() 微溶于水,易与较浓的强酸、强碱反应。
微溶于水,易与较浓的强酸、强碱反应。
下列说法不正确的是
A.![]() 中,
中,![]() 的化合价是-2
的化合价是-2
B.步骤②中,碱浸的离子方程式是![]()
C.步骤③中,阴极上发生反应的电极方程式是:![]()
D.在阳极区溶液中检验出有![]() 存在,可能原因是阳极生成的氧气氧化
存在,可能原因是阳极生成的氧气氧化![]() 得到
得到![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com