
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:mCeO2 (m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2
(m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO

下列说法不正确的是( )
A.该过程中CeO2没有消耗B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3D.H2(g)+O2(g)=H2O(g)的反应热大于ΔH3
【答案】C
【解析】
A.通过太阳能实现总反应H2O+CO2→H2+CO+O2,反应中CeO2没有消耗,CeO2作催化剂,A正确;
B.该过程中在太阳能作用下将H2O、CO2转变为H2、CO,所以把太阳能转变成化学能,B正确;
C.由图中转化关系及据盖斯定律可知:-△H1为正值,△H2+△H3为负值,则-△H1=△H2+△H3,C错误;
D.①H2(g)+O2(g)=H2O(l) ΔH3;②H2O(l)=H2O(g) △H2,根据盖斯定律①+②得:H2(g)+O2(g)=H2O(g) △H=△H3+△H2;因②△H、△H3都小于0,而△H2大于0,故△H>△H3,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】Cr、S等元素的化合物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)还原沉淀法是处理含铬(Cr2O72和CrO42)工业废水的常用方法,过程如下:
![]()
①已知:常温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。则上述流程中CrO42-转化为Cr2O72-的离子方程式为______________________。

②还原过程中氧化剂与还原剂的物质的量之比为__________。
③Cr3+与Al3+的化学性质相似,对CrCl3溶液蒸干并灼烧,最终得到的固体的化学式为____________。
④常温下,Ksp[Cr(OH)3]=1.0×10-32,欲使处理后废水中的c(Cr3+)降至1.0×10-5mol·L1(即沉淀完全),应调节至溶液的pH=_____。
(2)“亚硫酸盐法”吸收烟中的SO2
①将烟气通入1.0mol/L 的Na2SO3溶液,当Na2SO3恰好完全反应时,溶液pH约为3,此时,溶液中各种离子浓度由大到小的顺序为_________(用离子浓度符号和“>”号表示)。
②室温下,将烟道气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。

已知部分弱电解质的电离常数(25℃)如下:
电解质 | 电离常数 |
H2SO3 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
NH3·H2O | Kb=1.74×10-5 |
(i)(NH4)2SO3溶液呈____(填“酸”、“碱”或“中”)性,其原因是_________________。
(ii)图中b点时溶液pH=7,则n(NH4+):n(HSO3- )=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是s能级和p能级的原子轨道图,试回答下列问题:
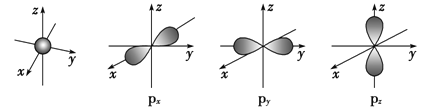
(1)s电子的原子轨道呈______形,每个s能级有______个原子轨道;p电子的原子轨道呈________形,每个p能级有________个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是________电子,其电子云在空间有________方向;元素X的名称是_______,它的氢化物的电子式是____________。若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为________,原子的电子排布图为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的结构简式如图所示。下列说法错误的是( )

A.有机物X的分子式为C20H18O4
B.1mol有机物X最多可以和8molH2加成
C.1mol有机物X最多消耗2molNaOH
D.苯环上的一氯取代产物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,有关说法正确的是( )

A.铝罐将逐渐被腐蚀
B.碳粒和碳棒上发生的反应为O2+2H2O-4e-=4OH-
C.碳棒应与玩具电机的负极相连
D.该电池工作一段时间后碳棒和碳粒的质量会减轻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,我国科学家实现了CO2的捕获与转化,装置如图所示,利用其能吸收二氧化碳,并产生有价值的物质,该设计在国际期刊《JournalofEnergyChemistry》中发表。下列有关说法正确的是( )
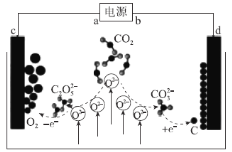
A.电源在使用过程中,b极发生还原反应
B.该装置实现了CO2的化学能转化为电能
C.利用该装置的原理,理论上也可用于捕获与转化硫氧化物、氮氧化物
D.若电源中有4mol电子转移,则最多可捕获CO222.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用沉淀滴定法快速测定NaBr等卤化物溶液中c(Br-),实验过程包括标准溶液的配制和滴定待测溶液。
I.标准溶液的配制
准确称取AgNO3基准物8.5g,配制成500mL标准溶液,放在棕色试剂瓶中避光保存,备用。
II.滴定的主要步骤
a.取待测NaBr溶液25.00mL,配制成100mL溶液,取其中25.00mL于锥形瓶中。
b.加入K2CrO4溶液作指示剂。
c.用AgNO3标准溶液进行滴定,记录消耗的体积。
d.重复上述操作三次,测定数据如下表:

e.数据处理。
请回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的玻璃仪器除烧杯和玻璃棒外还有___,配制的AgNO3溶液的浓度为___。
(2)AgNO3标准溶液应使用___ (填“酸式”或“碱式”)棕色滴定管,检漏后装液前需要进行的操作有___。
(3)实验可用铬酸钾(K2CrO4)作指示剂,一方面,是由于Ag2CrO4是砖红色沉淀,现象变化明显,另一方面,是由于___。
(4)滴定应在近中性或弱碱性(6.5<pH<10.5)的条件下进行,其原因是酸性过强,发生如下离子反应:___;碱性过强,会导致___。
(5)达到滴定终点时的现象为___。
(6)由上述实验数据测得原溶液c(Br-)=___ mol·L-1。
(7)若在配制AgNO3标准溶液时,未洗涤玻璃棒和烧杯,则对c(Br-)测定结果的影响为___ (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车目前一般使用镍氢电池(M表示储包合金),电池总反应式为H2+2NiOOH![]() 2Ni(OH)2。汽车上坡或加速时,电动机提供推动力:下坡或刹车时,电池处于充电状态。下列说法中正确的是( )
2Ni(OH)2。汽车上坡或加速时,电动机提供推动力:下坡或刹车时,电池处于充电状态。下列说法中正确的是( )
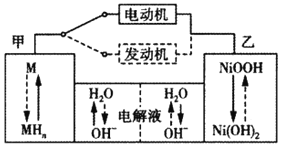
A.放电时甲为负极,充电时为阳极
B.汽车上坡时发生图中虚线所示的过程
C.汽车下坡电流的方向为:甲电极→发动机→乙电极
D.汽车下坡时,甲电极周围溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com