
ЎѕМвДїЎїЅьИХЈ¬ОТ№ъїЖС§јТКµПЦБЛCO2µДІ¶»сУлЧЄ»ЇЈ¬Ч°ЦГИзНјЛщКѕЈ¬АыУГЖдДЬОьКХ¶юСх»ЇМјЈ¬ІўІъЙъУРјЫЦµµДОпЦКЈ¬ёГЙијЖФЪ№ъјКЖЪїЇЎ¶JournalofEnergyChemistryЎ·ЦР·ў±нЎЈПВБРУР№ШЛµ·ЁХэИ·µДКЗЈЁ Ј©
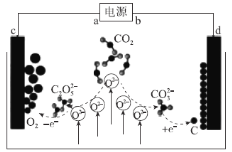
A.µзФґФЪК№УГ№эіМЦРЈ¬bј«·ўЙъ»№Ф·ґУ¦
B.ёГЧ°ЦГКµПЦБЛCO2µД»ЇС§ДЬЧЄ»ЇОЄµзДЬ
C.АыУГёГЧ°ЦГµДФАнЈ¬АнВЫЙПТІїЙУГУЪІ¶»сУлЧЄ»ЇБтСх»ЇОпЎўµЄСх»ЇОп
D.ИфµзФґЦРУР4molµзЧУЧЄТЖЈ¬ФтЧо¶аїЙІ¶»сCO222.4L
Ўѕґр°ёЎїC
ЎѕЅвОцЎї
ёщѕЭНјЖ¬їЙЦЄcј«C2O52-ЎъO2Ј¬·ўЙъСх»Ї·ґУ¦ЙъіЙµҐЦКO2Ј¬ЛщТФcОЄСфј«Ј¬dОЄТхј«Ј¬Сфј«УлµзФґХэј«ПаЅУЎўТхј«УлµзФґёєј«ПаЅУЈ¬јґaј«ОЄµзФґХэј«Ўўbј«ОЄµзФґёєј«ЎЈ
AЈ®bј«ОЄµзФґёєј«Ј¬ФµзіШЦРёєј«К§µзЧУ·ўЙъСх»Ї·ґУ¦Ј¬№КAґнОуЈ»
BЈ®ёГЧ°ЦГОЄµзЅвіШЈ¬їЙЅ«µзДЬЧЄ»ЇіЙ»ЇС§ДЬЈ¬№КBґнОуЈ»
CЈ®АыУГёГЧ°ЦГїЙЅ«CO2І¶»сЈ¬ЧЄ»ЇОЄCєНO2Ј¬ФтАнВЫЙПТІїЙТФЅ«БтСх»ЇОпЎўµЄСх»ЇОпІ¶»сЈ¬ПаУ¦µДЧЄ»ЇОЄSєНO2Ј¬N2єНO2Ј¬№КCХэИ·Ј»
DЈ®ОґЦёГчОВ¶ИєНС№ЗїЈ¬ОЮ·ЁјЖЛгЖшМеµДМе»эЈ¬№КDґнОуЈ»
№Кґр°ёОЄCЎЈ



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРУР№ШКµСйЧ°ЦГј°УГНѕРрКцНкИ«ХэИ·µДКЗ
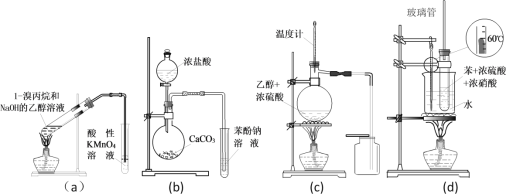
A. aЧ°ЦГјмСйПыИҐ·ґУ¦єуУР±ыП©ЙъіЙ
B. bЧ°ЦГјмСйЛбРФЈєСОЛбЈѕМјЛбЈѕ±Ѕ·У
C. cЧ°ЦГУГУЪКµСйКТЦЖИЎІўКХјЇТТП©
D. dЧ°ЦГУГУЪКµСйКТЦЖПх»щ±Ѕ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїп®»ФКЇ(ЦчТЄіЙ·ЦОЄLiAl(SiO3)2Ј¬»№є¬УРFe2O3ЎўMgOЎўAl2O3µИФУЦК)КЗЧоЦШТЄµДМбп®їуКЇФБПЈ¬№¤ТµЙПТФ¦Б-п®»ФКЇОЄФБПЦЖ±ёМјЛбп®Ј¬Ж乤ТХБчіМИзНјЈє

ТСЦЄЈєўЩ¦Б-п®»ФКЇ»ЇС§¶иРФґуЈ¬іэHFНвЈ¬јёєхІ»УлИОєОЛбјо·ґУ¦Ј¬¦Б-п®»ФКЇФЪёЯОВПВїЙЧЄ»ЇОЄ¦В-п®»ФКЇЈ¬¦В-п®»ФКЇѕЯУРёьёЯµД»ЇС§»оРФЎЈ
ўЪ¦В-п®»ФКЇїЙУлЕЁБтЛб·ўЙъ·ґУ¦Јє2¦В-LiAl(SiO3)2Ј«H2SO4(ЕЁ) ![]() Li2SO4Ј«Al2O3Ў¤4SiO2Ў¤H2OЎЈ
Li2SO4Ј«Al2O3Ў¤4SiO2Ў¤H2OЎЈ
ўЫІї·ЦЅрКфЗвСх»ЇОпїЄКјіБµнєННкИ«іБµнµДpHИзПВ±нЈє
ЗвСх»ЇОп | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
їЄКјіБµнpH | 2.7 | 3.7 | 9.6 |
НкИ«іБµнpH | 3.7 | 4.7 | 11 |
Зл»ШґрПВБРОКМвЈє
(1)Ѕ«LiAl(SiO3)2ёДРґіЙСх»ЇОпµДРОКЅОЄ___Ј¬1000Ўж±єЙХ¦Б-п®»ФКЇµДДїµДОЄ___ЎЈ
(2)ВЛФь2µДЦчТЄіЙ·ЦОЄ___Ј¬µчЅЪpHЦµµД·¶О§ОЄ___ЎЈ
(3)Ў°іэґуІї·ЦMgЎ±ІЅЦиµДАлЧУ·ЅіМКЅОЄ___ЎЈ
(4)КµСйКТХф·ўЕЁЛхІЩЧчЦРЛщРиµДТЗЖчОЄѕЖѕ«µЖЎўМъјЬМЁ(ґшМъИ¦)Ўў___ЎЈ
(5)ПґµУ№эіМЦРјмСйіБµнКЗ·сПґµУёЙѕ»µДІЩЧчОЄ___ЎЈ
(6)МјЛбп®КЗЦЖ±ёп®АлЧУµзіШµДФБПЦ®Т»Ј¬Діп®АлЧУµзіШТФCoP3ЧчОЄёєј«ІДБПЈ¬ТФLiMn1.5Ni0.5O4ЧчОЄХэј«ІДБПЈ¬ТФїЙґ«µј·ЕµзLiЈ«µДОЮ»ъ№ММеµзЅвЦКc-LATPЧчОЄµзЅвТєЈ¬Ж乤ЧчК±µзіШ·ґУ¦ОЄLi1-xMn1.5N0.5O4Ј«Lix(CoP3)n![]() LiMn1.5Ni0.5O4Ј«(CoP3)nЈ¬ФтёГµзіШ·ЕµзК±ёєј«µДµзј«·ґУ¦КЅОЄ___Ј¬ідµзК±Сфј«µДµзј«·ґУ¦КЅОЄ___ЎЈ
LiMn1.5Ni0.5O4Ј«(CoP3)nЈ¬ФтёГµзіШ·ЕµзК±ёєј«µДµзј«·ґУ¦КЅОЄ___Ј¬ідµзК±Сфј«µДµзј«·ґУ¦КЅОЄ___ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПЦУРИэЦЦїЙИЬРФОпЦКAЎўBЎўCЈ¬ЖдЦРAЎўBКЗСОЈ¬CКЗјоЈ¬ЛьГЗИЬУЪЛ®єуµзАлІъЙъµДЛщУРАлЧУИзПВ±нЛщКѕЈє
СфАлЧУ | NaЈ« HЈ« Ba2Ј« |
ТхАлЧУ | OHЈ CO32Ј SO42Ј |
ЗлёщѕЭПВБРРрКц»ШґрОКМвЈє
(1)CµД»ЇС§КЅОЄ_____________ЎЈ
(2)AИЬТєУлBИЬТє·ґУ¦їЙЙъіЙЖшМеXЈ¬ФтXµД»ЇС§КЅОЄ_______
(3)AЎўBИЬТєУлCИЬТє·ґУ¦їЙ·Ц±рЙъіЙ°ЧЙ«іБµнDєНEЈ¬ЖдЦРDїЙИЬУЪПЎПхЛб
ўЩ BµД»ЇС§КЅОЄ_____________Ј¬јш±рИЬТєBЦРµДТхАлЧУµД·Ѕ·ЁЈє___________________
ўЪ DИЬУЪПЎПхЛбµДАлЧУ·ЅіМКЅОЄ________________________________
ўЫ DУлEµД»мєПОпa gЈ¬јУИлЧгБїСОЛбЈ¬НкИ«·ґУ¦ЙъіЙµДЖшМеФЪ±кЧјЧґїцПВМе»эОЄb LЈ¬ФтЗуЛгEФЪ»мєПОпЦРµДЦКБї·ЦКэµД±нґпКЅОЄ________________________________________
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДіїЖС§јТАыУГ¶юСх»Їож(CeO2)ФЪМ«СфДЬЧчУГПВЅ«H2OЎўCO2ЧЄ±діЙH2ЎўCOЈ¬Жд№эіМИзПВЈєmCeO2 (mЈx)CeO2Ў¤xCe+xO2Ј»(m-x)CeO2Ў¤xCe+xH2O+xCO2
(mЈx)CeO2Ў¤xCe+xO2Ј»(m-x)CeO2Ў¤xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO

ПВБРЛµ·ЁІ»ХэИ·µДКЗ(ЎЎ ЎЎ)
A.ёГ№эіМЦРCeO2Г»УРПыєДB.ёГ№эіМКµПЦБЛМ«СфДЬПт»ЇС§ДЬµДЧЄ»Ї
C.НјЦР¦¤H1=¦¤H2+¦¤H3D.H2(g)+O2(g)=H2O(g)µД·ґУ¦ИИґуУЪ¦¤H3
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїµЪЛДЦЬЖЪФЄЛШФЪЙъІъЙъ»оЦРѕЯУРЦШТЄµДЧчУГЎЈЗл»ШґрПВБРОКМв:
(1)»щМ¬ScФЧУµДјЫµзЧУЕЕІјНјОЄ___________________ЎЈ
(2)Zn2+єНCN-ЎўK+їЙЧйіЙ»ЇєПОпK2Zn(CN)4,ЖдЦРґжФЪµД»ЇС§јьАаРНУР____________Ј»Zn(CN)42-ЦРµДЕдМеОЄ_______Ј¬ЕдО»ФЧУОЄ_____ ,УлёГЕдАлЧУЦРЕдМеµИµзЧУМеµД·ЦЧУОЄ___ЎЈ
(3)УлBrН¬ЦчЧеµД¶МЦЬЖЪФЄЛШУРFЎўCl,ХвИэЦЦФЄЛШµДјтµҐЗв»ЇОпHFЎўHClЎўHBrµД·РµгґУёЯµЅµНµДЛіРтОЄ___________Ј¬АнУЙОЄ______ЎЈ
(4)Fe-Cr-AlєПЅрїЙЧчОЄЖыіµОІЖшґЯ»ЇјБµДФШМе,ЖыіµОІЖшґЯ»ЇјБїЙЅ«NO2»№ФОЄОЮ¶ѕє¦µДЖшМе,·АЦ№HNO3РНЛбУкµДРОіЙ,NO2µДїХјд№№РНОЄ_____ЎЈHNO3µДЛбРФЗїУЪHNO2µДФТтОЄ____________________ЎЈ
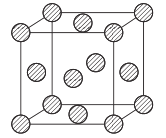
(5)ЅрКфНІЙУГГжРДБў·Ѕ¶С»э·ЅКЅ,Ждѕ§°ыЅб№№ИзНјЛщКѕЎЈТСЦЄёГѕ§°ыµДГЬ¶ИОЄ¦Сg. cm-3,ѕ§°ыІОКэОЄanm,°ў·ьЩ¤µВВЮіЈКэОЄNA,ФтНФЧУµДПа¶ФФЧУЦКБїµД±нґпКЅОЄ_______(УГє¬УЦѡўaЎўNAµД±нґпКЅ±нКѕ)ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїWЎўXЎўYЎўZ ЛДЦЦ¶МЦЬЖЪФЄЛШЈ¬ЛьГЗФЪЦЬЖЪ±нЦРО»ЦГИзНјЛщКѕЈ¬ПВБРЛµ·ЁХэИ·µДКЗ
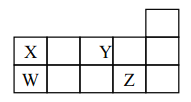
A. ЛДЦЦФЄЛШЦРФЧУ°лѕ¶ЧоґуОЄ WЈ¬ Y µДЗв»ЇОпОИ¶ЁРФЧоЗї
B. ЛДЦЦФЄЛШЧоёЯјЫСх»ЇОпµДЛ®»ЇОп¶јКЗЛб
C. XZ4Ўў WY2ЦРЛщє¬»ЇС§јьАаРНПаН¬Ј¬ИЫµг¶јєЬёЯ
D. WЎў X РОіЙµДµҐЦК¶јКЗЦШТЄµД°лµјМеІДБП
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїОЄИ·¶Ё»мєПѕщФИµДNH4NO3єНЈЁNH4Ј©2SO4СщЖ·ЧйіЙЈ¬іЖИЎ4·ЭСщЖ··Ц±рјУИл50.0mLПаН¬ЕЁ¶ИµДNaOHИЬТєЦРЈ¬јУИИід·Ц·ґУ¦ЈЁИЬТєЦРµДп§ёщАлЧУИ«ІїЧЄ»ЇОЄ°±ЖшЈ¬ЗТјУИИєу°±ЖшИ«ІїТЭіцЈ©Ј®јУИлµД»мєПОпµДЦКБїєНІъЙъµДЖшМеМе»эЈЁ±кЧјЧґїцЈ©µД№ШПµИз±нЈє
КµСйРтєЕ | I | II | III | IV |
NaOHИЬТєµДМе»эЈЁmLЈ© | 50.0 | 50.0 | 50.0 | 50.0 |
СщЖ·ЦКБїЈЁgЈ© | 3.44 | m | 17.2 | 21.5 |
NH3Ме»эЈЁLЈ© | 1.12 | 2.24 | 5.60 | 5.60 |
КФјЖЛгЈє
ЈЁ1Ј©m=_____gЈ»cЈЁNaOHЈ©=_____molL©Ѓ1ЎЈ
ЈЁ2Ј©СщЖ·ЦРNH4NO3єНЈЁNH4Ј©2SO4ОпЦКµДБїЦ®±ИОЄ_____ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТСЦЄXЎўYЎўZЎўWѕщОЄЦРС§»ЇС§ЦРіЈјыµДµҐЦК»т»ЇєПОпЈ¬ЛьГЗЦ®јдµДЧЄ»Ї№ШПµИзНјЛщКѕЈЁІї·ЦІъОпТСВФИҐЈ©ЎЈФтWЎўXІ»їЙДЬКЗЈЁ Ј©
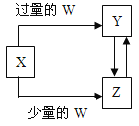
СЎПо | W | X |
A | СОЛб | Na2CO3ИЬТє |
B | Cl2 | Fe |
C | CO2 | Ca(OH)2ИЬТє |
D | NaOH | AlCl3ИЬТє |
A.AB.BC.CD.D
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com