
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )
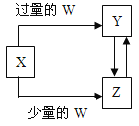
选项 | W | X |
A | 盐酸 | Na2CO3溶液 |
B | Cl2 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | NaOH | AlCl3溶液 |
A.AB.BC.CD.D
【答案】B
【解析】
A、碳酸钠与过量的盐酸反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,Na2CO3与少量的HCl反应生成NaHCO3,NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,NaHCO3+HCl=NaCl+CO2↑+H2O,符合转化关系,故A说法正确;
B、Fe与过量的氯气反应生成FeCl3,铁与少量的氯气反应,也生成FeCl3,不符合关系,故B说法错误;
C、Ca(OH)2与过量的CO2反应生成Ca(HCO3)2,与少量的CO2反应生成CaCO3,Ca(HCO3)2与碱反应生成CaCO3,CaCO3与CO2、H2O反应生成Ca(HCO3)2,符合转化关系,故C说法正确;
D、Al3+与过量NaOH反应生成NaAlO2,与少量的NaOH反应生成Al(OH)3,Al(OH)3继续与NaOH反应生成NaAlO2,NaAlO2与酸反应生成Al(OH)3,符合转化关系,故D说法正确。


科目:高中化学 来源: 题型:
【题目】近日,我国科学家实现了CO2的捕获与转化,装置如图所示,利用其能吸收二氧化碳,并产生有价值的物质,该设计在国际期刊《JournalofEnergyChemistry》中发表。下列有关说法正确的是( )
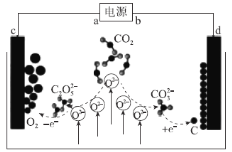
A.电源在使用过程中,b极发生还原反应
B.该装置实现了CO2的化学能转化为电能
C.利用该装置的原理,理论上也可用于捕获与转化硫氧化物、氮氧化物
D.若电源中有4mol电子转移,则最多可捕获CO222.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铁常用于检测硒、污水处理等,其制备和元素含量测定方法有多种。 请回答下列问题:
(1)方法一:用H2还原无水FeCl3制备, 已知FeCl2、 FeCl3易吸水。实验所需装置如下:
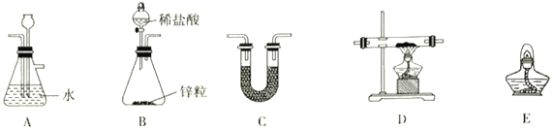
按气流从左到右的方向,装置的连接顺序为_________(仪器可重复使用)。
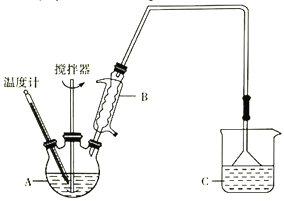
(2)方法二:用如图装置(夹持装置省略)制备氯化亚铁,发生反应2FeCl3+C6H6Cl→ 2FeCl2+C6H4Cl2+HCl。向A中加入无水氯化铁和氯苯,控制反应温度在一定范围加热一段时间。
相关物质的部分物理性质如表:
C6H5Cl(氯苯) | 对二氯苯 | 邻二氯苯 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | |||
熔点/℃ | -45 | 53 | -15 | — | — |
沸点/℃ | 132 | 173 | 180.5 | — | — |
①仪器B的名称是_________; 反应的温度最好控制在______左右:反应结束后,冷却实验装置,将仪器A内物质经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂是________。
②通过烧杯中的现象变化可监测反应的转化率,则烧杯C中所加试剂是_______。
③过滤液中含氯苯、邻二氯苯和对二氯苯,下列方法可用于鉴别氯苯和对二氯苯的是________。
a.质谱法 b.核磁共振氢谱法 c.元素分析法
(3)某同学用滴定法测定产品中铁元素含量,其测定过程如图:
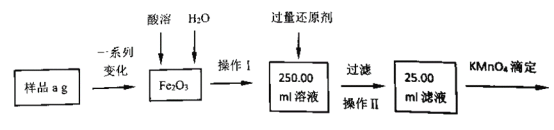
①该过程中酸溶时选择的最佳试剂是____;还原剂是_______。
②若滴定过程中消耗c mol·L-1KMnO4溶液VmL,则样品中铁元素的质量分数是_____。 (用含a、c、V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部转化到产品中,实现“零排放”。下列反应符合绿色化学这一特点的是( )
A.工业冶炼Fe2O3 + 3CO![]() 2Fe + 3CO2
2Fe + 3CO2
B.实验室制取二氧化碳CaCO3+2HCl=CaCl2+H2O+CO2↑
C.用生石灰制熟石灰CaO+H2O=Ca(OH)2
D.实验室制取氢气Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中含氧原子的物质的量一定相同的是
A. 3.36L O2 和 0.3 mol H2O
B. 0.1 mol H2SO4 和 3.6 g H2O
C. 0.1 mol FeSO4·7H2O 和 0.1 mol C12H22O11(蔗糖)
D. 6.02×1023 个 CO2 与 0.1 mol KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某些地区曾出现过高致病性禽流感,为防止疫情蔓延,必须迅速进行隔离,并对受禽流感病毒污染的禽舍、工具等进行消毒。资料显示:禽流感病毒在高温、碱性环境(如氢氧化钠溶液)、高锰酸钾或次氯酸钠等消毒剂中生存能力较差。请回答下列问题:
(1)次氯酸钠(NaClO)属于__________(填“酸”、“碱”、“盐”或“氧化物”),其中氯元素的化合价为________价。
(2)用加热高锰酸钾熏蒸消毒禽舍,写出所发生反应的化学方程式:________________。
(3)以下对受污染工具的消毒方法可行的是_________________(填字母代号)。
a.用NaClO溶液浸泡 b.用NaOH溶液浸泡 c.用水冲洗即可
(4)配制用的0.5L 0.2mol.L-1的NaCl溶液,需用天平称取固体NaCl________。 若在实验室中配制此溶液,需要用到的玻璃仪器有胶头滴管 ____________________、量筒和玻璃棒。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是登山运动常用的能源提供剂,氢化钙要封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙通常用氢气与金属钙加热制取,图1是模拟制取装置。
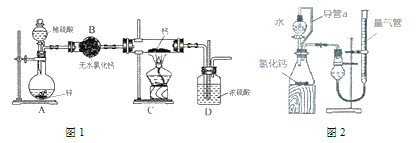
回答下列问题:
(1)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品,打开分液漏斗活塞_____(请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(2)为了确认进人装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是___,装置D的作用是________。
(3)某同学利用图2装置测定上述实验中得到的氢化钙的含量。他称取m g所制得的氢化钙样品,实验前后量气管中液面读数分别为V1 mL、V2 mL。(上述气体体积均换算为标准状况下)
①装置中导管a的作用是_______。
②如何判断样品与水完全反应:______。
③产生的氢气体积为________mL。若未冷却至室温即读数,则氢化钙含量_______(填“偏高”、“偏低”、“无影响”)。
(4)请你再设计一种氢化钙纯度的测定方法:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )
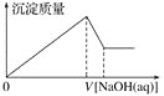
A. 有Mg2+,没有Al3+
B. 有Al3+,没有Mg2+
C. 有Mg2+和Al3+
D. 有大量的H+、Mg2+和Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com