
【题目】氯化亚铁常用于检测硒、污水处理等,其制备和元素含量测定方法有多种。 请回答下列问题:
(1)方法一:用H2还原无水FeCl3制备, 已知FeCl2、 FeCl3易吸水。实验所需装置如下:
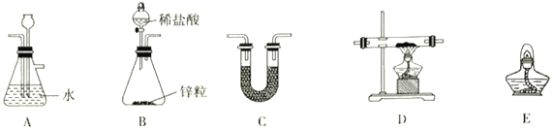
按气流从左到右的方向,装置的连接顺序为_________(仪器可重复使用)。
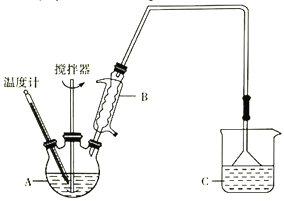
(2)方法二:用如图装置(夹持装置省略)制备氯化亚铁,发生反应2FeCl3+C6H6Cl→ 2FeCl2+C6H4Cl2+HCl。向A中加入无水氯化铁和氯苯,控制反应温度在一定范围加热一段时间。
相关物质的部分物理性质如表:
C6H5Cl(氯苯) | 对二氯苯 | 邻二氯苯 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | |||
熔点/℃ | -45 | 53 | -15 | — | — |
沸点/℃ | 132 | 173 | 180.5 | — | — |
①仪器B的名称是_________; 反应的温度最好控制在______左右:反应结束后,冷却实验装置,将仪器A内物质经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂是________。
②通过烧杯中的现象变化可监测反应的转化率,则烧杯C中所加试剂是_______。
③过滤液中含氯苯、邻二氯苯和对二氯苯,下列方法可用于鉴别氯苯和对二氯苯的是________。
a.质谱法 b.核磁共振氢谱法 c.元素分析法
(3)某同学用滴定法测定产品中铁元素含量,其测定过程如图:
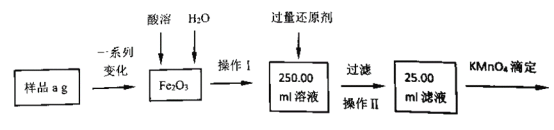
①该过程中酸溶时选择的最佳试剂是____;还原剂是_______。
②若滴定过程中消耗c mol·L-1KMnO4溶液VmL,则样品中铁元素的质量分数是_____。 (用含a、c、V的代数式表示)
【答案】BCDCE或者BACDCE 球形冷凝管 132℃ 苯 滴有酚酞的氢氧化钠溶液或者硝酸银溶液 ab 稀硫酸(H2SO4) 铜(Cu) ![]()
【解析】
(1)用氢气还原无水氯化铁制备氯化亚铁。装置B制备氢气,制得氢气中混有挥发出来的HCl和水蒸气,装置A可以进行除杂HCl气体同时检验气体流速, C装置进行除杂HCl气体同时干燥氢气,因此C装置应盛放碱石灰。D装置用于氢气还原氯化铁的发生装置,E装置点燃剩余的氢气。由于FeCl2、 FeCl3易吸水,D装置后面也需要连接干燥装置,防止空气中的水蒸气进入D。因此装置的连接顺序为BCDCE或者BACDCE;
(2) ①仪器B的名称是球形冷凝管;反应容器中温度控制在132℃,对应化学反应速率最快,若温度过高,氯苯挥发降低了原料的利用率,因此反应的温度最好控制在132℃左右;反应结束后,冷却实验装置,仪器A内有四种物质C6H5Cl(氯苯)、二氯苯、FeCl3、FeCl2,经过过滤得固体FeCl2(主要)和FeCl3(未反应完),根据溶解度用苯洗去固体表面的氯苯以及二氯苯,干燥得粗产品,故洗涤所用的试剂是苯;
②过程中生成的HCl气体通过导气管进入C装置中,C装置的作用吸收挥发出来的HCl气体同时反馈反应进行的程度,若烧杯C中所加试剂是滴有酚酞的氢氧化钠溶液,反应开始后,C烧杯中碱性减弱酚酞颜色会逐渐变浅,若颜色不在变化说明三颈烧瓶中反应完全;若烧杯C中所加试剂是硝酸银溶液,开始反应后C中出现白色沉淀氯化银,若沉淀不再增加,说明三颈烧瓶中反应完全;故通过烧杯中的现象变化可监测反应的转化率,则烧杯C中所加试剂是滴有酚酞的氢氧化钠溶液或者硝酸银溶液;
③质谱法用于测定有机物的相对分子质量,不能区分同分异构体,可以鉴别氯苯和对二氯苯;核磁共振氢谱用于检测有机物中的等效氢,氯苯中等效氢有3种,对二氯苯中的等效氢有1种,可以鉴别氯苯和对二氯苯;元素分析法包括定量分析和定性分析,定性分析只能测定有机物中元素的种类,定量分析法可以测定元素种类和含量;本题只说元素分析没有指明是定量还是定性分析,那么不一定能鉴别氯苯和对二氯苯。故可用于鉴别氯苯和对二氯苯的是质谱法和核磁共振氢谱法,选ab;
(3) ①该过程溶解不能选用盐酸,引入的Cl-会与高锰酸钾发生氧化还原反应,对数据有干扰,也不能使用硝酸,具有氧化性,在后续加入过量还原剂会产生污染性气体,故酸溶时选择最佳的试剂是稀硫酸;还原剂选用过量的铜,不与滤液中的硫酸反应,只与Fe2(SO4)3反应,反应完成后过滤进行分离。若选用铁会引入铁元素干扰数据。故还原剂是铜;
②根据测定过程中的化学反应原理MnO4-+5Fe2++8H+= Mn2++5Fe3++4H2O,n(KMnO4)= c mol·L-1×V×10-3L=10-3cVmol,则25mL滤液中有n(Fe2+)=5n(KMnO4)=5×10-3cVmol,则250mL滤液中有n(Fe2+)=5×10-2cVmol,m(Fe2+)=2.8 cV g,则a g样品中铁元素的质量分数是![]() 。
。


科目:高中化学 来源: 题型:
【题目】锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、MgO、Al2O3等杂质)是最重要的提锂矿石原料,工业上以α-锂辉石为原料制备碳酸锂,其工艺流程如图:

已知:①α-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应,α-锂辉石在高温下可转化为β-锂辉石,β-锂辉石具有更高的化学活性。
②β-锂辉石可与浓硫酸发生反应:2β-LiAl(SiO3)2+H2SO4(浓) ![]() Li2SO4+Al2O3·4SiO2·H2O。
Li2SO4+Al2O3·4SiO2·H2O。
③部分金属氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
请回答下列问题:
(1)将LiAl(SiO3)2改写成氧化物的形式为___,1000℃焙烧α-锂辉石的目的为___。
(2)滤渣2的主要成分为___,调节pH值的范围为___。
(3)“除大部分Mg”步骤的离子方程式为___。
(4)实验室蒸发浓缩操作中所需的仪器为酒精灯、铁架台(带铁圈)、___。
(5)洗涤过程中检验沉淀是否洗涤干净的操作为___。
(6)碳酸锂是制备锂离子电池的原料之一,某锂离子电池以CoP3作为负极材料,以LiMn1.5Ni0.5O4作为正极材料,以可传导放电Li+的无机固体电解质c-LATP作为电解液,其工作时电池反应为Li1-xMn1.5N0.5O4+Lix(CoP3)n![]() LiMn1.5Ni0.5O4+(CoP3)n,则该电池放电时负极的电极反应式为___,充电时阳极的电极反应式为___。
LiMn1.5Ni0.5O4+(CoP3)n,则该电池放电时负极的电极反应式为___,充电时阳极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z 四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
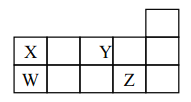
A. 四种元素中原子半径最大为 W, Y 的氢化物稳定性最强
B. 四种元素最高价氧化物的水化物都是酸
C. XZ4、 WY2中所含化学键类型相同,熔点都很高
D. W、 X 形成的单质都是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定混合均匀的NH4NO3和(NH4)2SO4样品组成,称取4份样品分别加入50.0mL相同浓度的NaOH溶液中,加热充分反应(溶液中的铵根离子全部转化为氨气,且加热后氨气全部逸出).加入的混合物的质量和产生的气体体积(标准状况)的关系如表:
实验序号 | I | II | III | IV |
NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
样品质量(g) | 3.44 | m | 17.2 | 21.5 |
NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
试计算:
(1)m=_____g;c(NaOH)=_____molL﹣1。
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与消耗的HC1物质的量关系如图所示(忽略气体的溶解和HC1的挥发).下列说法不正确的是
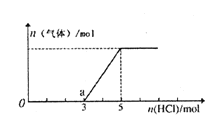
A. 0点溶液中所含溶质的化学式为NaOH、Na2CO3
B. 0到a点发生反应的离子方程式:H++OH-=H2O、CO32-+H+=HCO3-
C. 通入CO2气体的体积在标准状况下为22.4L
D. NaOH溶液的物质的量浓度为2.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
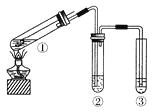
A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、NH4+、Fe2+、K+、SO32-、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
A.肯定不含K+
B.肯定含有SO32-、K+
C.肯定不含SO42-
D.肯定含有NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )
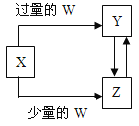
选项 | W | X |
A | 盐酸 | Na2CO3溶液 |
B | Cl2 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | NaOH | AlCl3溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读体检报告呈现的的部分内容,判断下列说法不正确的是
项目名称 | 检查结果 | 单位 | 参考范围 |
钾 | 4.1 | mmol/L | 3.5~5.5 |
钙 | 2.15 | mmol/L | 2.13~2.70 |
胱抑素C | 0.78 | mg/L | 0.59~1.03 |
尿素 | 4.18 | mmol/L | 2.78~7.14 |
甘油三酯 | 1.50 | mmol/L | 0.45~1.70 |
A.体检指标均以物质的量浓度表示
B.表中所示的检查项目均正常
C.尿素是蛋白质的代谢产物
D.甘油三酯的结构可表示为![]() (R1、R2、R3为烃基)
(R1、R2、R3为烃基)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com