
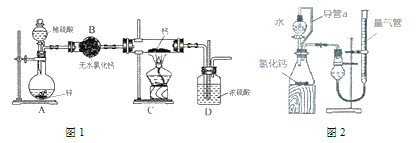
����Ŀ���⻯�ƣ�CaH2�������ǵ�ɽ�˶����õ���Դ�ṩ�����⻯��Ҫ�Ᵽ�棬һ���Ӵ���ˮ�ͷ�����Ӧ�����������ƺ��������⻯��ͨ��������������Ƽ�����ȡ��ͼ1��ģ����ȡװ�á�
�ش��������⣺
��1������ͼ1ʵ��װ�ý���ʵ�飬ʵ�鲽�����£����װ�������Ժ�װ��ҩƷ����Һ©������_____���밴��ȷ��˳���������в������ţ���
�ټ��ȷ�Ӧһ��ʱ�� ���ռ����岢�����䴿��
�۹رշ�Һ©������ ��ֹͣ���ȣ������ȴ
��2��Ϊ��ȷ�Ͻ���װ��C�������Ѿ����Ӧ��B��C֮���ٽ�һװ�ã���װ���м�����Լ���___��װ��D��������________��
��3��ijͬѧ����ͼ2װ�òⶨ����ʵ���еõ����⻯�Ƶĺ���������ȡm g���Ƶõ��⻯����Ʒ��ʵ��ǰ����������Һ������ֱ�ΪV1 mL��V2 mL���������������������Ϊ��״���£�
��װ���е���a��������_______��
������ж���Ʒ��ˮ��ȫ��Ӧ��______��
�۲������������Ϊ________mL����δ��ȴ�����¼����������⻯�ƺ���_______������ƫ��������ƫ����������Ӱ��������
��4�����������һ���⻯�ƴ��ȵIJⶨ������__________��
���𰸡��ڢ٢ܢ� ��ˮ����ͭ ��ֹ�����е�ˮ��������Cװ�� ƽ���Һ©������ƿ������ѹǿ��ʹ��Һ©���е�ˮ˳�����£�ͬʱʹ������ƿ��ˮ��������ڽ����Һ©���ڵ�����������Ӷ��������ڼ���ϡ������������������� ����Ͳ��Һ�治�ٱ仯 V1-V2 ƫ�� ��ȡһ��������Ʒ��m1 g��������������Һ������ð���ݣ���Ӧ��ȫ����Ȼ����Һ�����õ��Ȼ��ƹ��壨m2 g��������m1��m2���ɵõ��⻯�ƵĴ��ȡ�
��������
��������Ϣ��װ��AΪϡ�����п�������û���Ӧ����H2��װ�ã��������������д���ˮ���������⻯�ƽӴ���ˮʱ������Ӧ�����������ƺ�������H2�ڷ������ȷ�Ӧ֮ǰ��Ҫ���װ��BΪ����H2��װ�ã�CΪ�������������Ƶ��⻯�Ƶ�װ�ã�DΪ���տ����е�ˮ������װ�ã��ݴ˷���������⡣
(1)������μӼ��Ȼ�ȼ�յķ�Ӧ��Ҫ�����鴿��ʵ����Ϻ���Ϩ����ȴ����ֹͣ�������ɣ���ֹ����������ը����ȷ�IJ���˳��Ϊ���ڢ٢ܢۣ��ʴ�Ϊ���ڢ٢ܢۣ�
(2)�⻯�ƽӴ���ˮʱ������Ӧ�����������ƺ�������H2�ڷ������ȷ�Ӧ֮ǰ��Ҫ���һ������ˮ�Ȼ��ƣ�װ��B�������dz�ȥ�����е�ˮ������Ϊ�˼��������е�ˮ�����Ѿ���ȫ��ȥ��Ӧ��B��C֮���ٽ�һװ����ˮ����ͭ��װ�ã�װ��D�������Ƿ�ֹ�����е�ˮ��������Cװ�ã��ʴ�Ϊ����ˮ����ͭ����ֹ�����е�ˮ��������Cװ�ã�
(3)�ٵ���a������ƽ��ѹǿ�����ã��Ӷ�����Һ�����£�Ҳ�����������Һ�������ѹǿ��ʴ�Ϊ��ƽ���Һ©������ƿ������ѹǿ��ʹ��Һ©���е�ˮ˳�����£�ͬʱʹ������ƿ��ˮ��������ڽ����Һ©���ڵ�����������Ӷ��������ڼ���ϡ������������������
�ڵ��������е�Һ�治�ٱ仯ʱ��Ӧ����ȫ���ʴ�Ϊ������Ͳ��Һ�治�ٱ仯��
�۶����Ϊ��������������������������������Ϊ(V1-V2)mL��δ��ȴʹ�ò�õ������ʵ����������ս��ƫ�ߣ��ʴ�Ϊ��ƫ�ߣ�
(4)�������Ϣ������֪���⻯�ƿ����ᷴӦ��������⻯�ƴ��ȣ��ɳ�ȡһ��������Ʒ(m1 g)������������Һ������ð����(��Ӧ��ȫ)��Ȼ����Һ�����õ��Ȼ��ƹ���(m2 g)������m1��m2���ɵõ��⻯�ƵĴ��ȣ��ʴ�Ϊ����ȡһ��������Ʒ(m1 g)������������Һ������ð����(��Ӧ��ȫ)��Ȼ����Һ�����õ��Ȼ��ƹ���(m2 g)������m1��m2���ɵõ��⻯�ƵĴ��ȡ�


 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊȷ����Ͼ��ȵ�NH4NO3�ͣ�NH4��2SO4��Ʒ��ɣ���ȡ4����Ʒ�ֱ����50.0mL��ͬŨ�ȵ�NaOH��Һ�У����ȳ�ַ�Ӧ����Һ�е�笠�����ȫ��ת��Ϊ�������Ҽ��Ⱥ���ȫ���ݳ���������Ļ����������Ͳ����������������״�����Ĺ�ϵ�����
ʵ����� | I | II | III | IV |
NaOH��Һ�������mL�� | 50.0 | 50.0 | 50.0 | 50.0 |
��Ʒ������g�� | 3.44 | m | 17.2 | 21.5 |
NH3�����L�� | 1.12 | 2.24 | 5.60 | 5.60 |
�Լ��㣺
��1��m=_____g��c��NaOH��=_____molL��1��
��2����Ʒ��NH4NO3�ͣ�NH4��2SO4���ʵ���֮��Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W��Ϊ��ѧ��ѧ�г����ĵ��ʻ������֮���ת����ϵ��ͼ��ʾ�����ֲ�������ȥ������W��X�������ǣ� ��
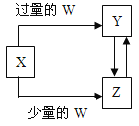
ѡ�� | W | X |
A | ���� | Na2CO3��Һ |
B | Cl2 | Fe |
C | CO2 | Ca(OH)2��Һ |
D | NaOH | AlCl3��Һ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��������ʯ��ļ����̣�����ƽ���ƶ�ԭ��������CaCO3����Һ��ͨ��SO2������Ӧ��ԭ��______��
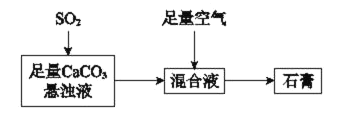
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������������б���ʴΪ�غ�ɫ����FeCl3����������������dz��ɫ��FeCl2��Һ����Cl2��Cl����H���У����������Ե���____________��������������ǿ����____________��
��2�������ڲ�ͬ�ķ�Ӧ�п��Էֱ���ֳ����ԡ������Ժͻ�ԭ�ԡ�����������������Ӧ����д��������������Ӧ�зֱ���������ã�
��Zn��2HCl===ZnCl2��H2��____________________��
��NaOH��HCl===NaCl��H2O__________________��
��2HCl![]() H2����Cl2��________________________��
H2����Cl2��________________________��
��3�������������б���ʴ���غ�ɫ����FeCl3����������������dz��ɫ��Һ(FeCl2)����Ũ�����еμ�KMnO4��Һ����������ɫ����(Cl2)����Cl2��H����![]() �У�__________________��������ǿ��
�У�__________________��������ǿ��
��4�������������������Һ���Է������з�Ӧ��2KMnO4��16HBr===5Br2��2MnBr2��2KBr��8H2O�����л�ԭ����________________��������15.8 g���������������Ļ�ԭ����������______________g��HBr��������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D���ֻ�����ֱ���K+��Ba2+��SO��2����CO32��OH���е�������ɣ����Ǿ����������ʣ�
��A������ˮ�������B������ˮ�����������ᣬ���ų���ɫ�̼�����ζ������E����C��ˮ��Һ�ʼ��ԣ������ᷴӦ����A����D������ˮ������������ʱ�ų�����E��E��ʹ����ʯ��ˮ����ǡ�
(1)�ƶ�A��B��C��D�Ļ�ѧʽ��
A��________��B��________��C��________��D��________��
(2)д�����з�Ӧ�����ӷ���ʽ��
B�����ᷴӦ��_______________________________________________��
C�����ᷴӦ��_______________________________________________��
E(����)�����ʯ��ˮ��Ӧ��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ���챨����ֵĵIJ������ݣ��ж�����˵������ȷ����
��Ŀ���� | ����� | ��λ | �ο���Χ |
�� | 4.1 | mmol/L | 3.5~5.5 |
�� | 2.15 | mmol/L | 2.13~2.70 |
������C | 0.78 | mg/L | 0.59~1.03 |
���� | 4.18 | mmol/L | 2.78~7.14 |
�������� | 1.50 | mmol/L | 0.45~1.70 |
A.���ָ��������ʵ���Ũ�ȱ�ʾ
B.������ʾ�ļ����Ŀ������
C.�����ǵ����ʵĴ�л����
D.���������Ľṹ�ɱ�ʾΪ![]() ��R1��R2��R3Ϊ������
��R1��R2��R3������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۲�����ʵ��װ��ͼ����Ҫ������

��1��д��ͼ��ʵ����������ƣ���_____ ��_____
��2��װ���������в������������ƣ�_____��_____
��3������ʵ����Ҫ������װ���н��У�������ţ�ÿ��װ�ý�ʹ��һ�Σ�
�� KCl��Һ�л�ȡKCl����_____���Ӻ�ˮ����ȡˮ_____������CaCO3��ˮ_____������ֲ���ͺ�ˮ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaOH��Na2CO3�����Һ�еμ�0.1mol��L��1ϡ���ᣬCO2���������������������(V)�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��

A.��0��a��Χ�ڣ�ֻ�����кͷ�Ӧ
B.a��0.3
C.ab�η�����Ӧ�����ӷ���ʽΪCO32-��2H��=CO2����H2O
D.ԭ�����Һ��NaOH��Na2CO3�����ʵ���֮��Ϊ1��2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com