
【题目】有机物X的结构简式如图所示。下列说法错误的是( )

A.有机物X的分子式为C20H18O4
B.1mol有机物X最多可以和8molH2加成
C.1mol有机物X最多消耗2molNaOH
D.苯环上的一氯取代产物有4种
【答案】D
【解析】
A.有机物X含有20个C原子,又不饱和度为12,可求得H原子数为18,由图可知有机物X含有4个O原子,综上,有机物X的分子式为C20H18O4,A项正确;
B.每个苯环可与3个氢气分子发生加成反应,每个碳碳双键可与1个氢气分子发生加成反应,每个羰基可与1 个氢气分子发生加成反应,酯基不能和氢气发生加成反应,故1 mol有机物X最多可以和8molH2加成,B项正确;
C.有机物X中的酯基在碱性条件下水解得到一个羧基和一个酚羟基,羧基和酚羟基都可以和氢氧化钠反应,有机物X中的醇羟基不可以和氢氧化钠反应,故1 mol有机物X最多消耗2 mol NaOH,C项正确;
D.左边苯环不含有对称结构,一氣取代产物有4种,右边苯环含有对称结构,一氯取代产物有2种,故有机物X苯环上的一氯取代产物有6种,D项错误;
故答案为D。


科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、NO2吸收,原理如下图所示。
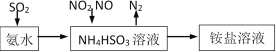
请写出NO2被吸收反应的离子方程式___________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:反应Ⅰ:2NO(g)+O2(g)==2NO2(g) ΔH1 =—113.0 kJ·molˉ1
反应Ⅱ:2SO2(g)+O2(g)==2SO3(1) ΔH2 =—288.4 kJ·molˉ1
反应Ⅲ:3NO2(g)+H2O(g)==2HNO3+NO(g) ΔH3 =—138.0 kJ·molˉ1
则反应NO2(g)+SO2(g)==NO(g)+SO3(1) ΔH4= _______________。
②已知TiO2催化尾气降解原理可表示为:2CO(g)+O2(g) ![]() 2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g)
2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g) ![]() 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图所示。请解释ts后NO降解率下降的可能原因_____________________。
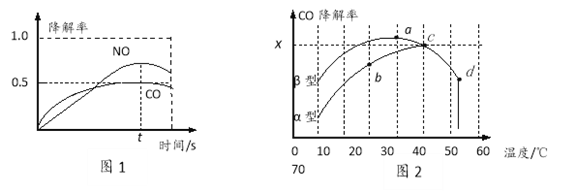
(3)沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L—1,求此温度下CO降解反应的平衡常数_______________。
②下列关于如图的叙述正确的是_________________
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.200molL-1盐酸滴定 20.00mL 0.200 molL-1 的 NaY 溶液,溶液中水的电离程度随所加盐酸的体积变化如图所示(忽略滴定过程中溶液体积变化),则下列有关说法正确的是[已知 Ka(HY)=5.0×10-11]

A.可选取酚酞作为滴定指示剂B.M 点溶液的 pH>7
C.Q 点水的电离程度最小,Kw<l0-14D.M点,c(Na+)=c (HY)+c (Y-)+c (Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、MgO、Al2O3等杂质)是最重要的提锂矿石原料,工业上以α-锂辉石为原料制备碳酸锂,其工艺流程如图:

已知:①α-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应,α-锂辉石在高温下可转化为β-锂辉石,β-锂辉石具有更高的化学活性。
②β-锂辉石可与浓硫酸发生反应:2β-LiAl(SiO3)2+H2SO4(浓) ![]() Li2SO4+Al2O3·4SiO2·H2O。
Li2SO4+Al2O3·4SiO2·H2O。
③部分金属氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
请回答下列问题:
(1)将LiAl(SiO3)2改写成氧化物的形式为___,1000℃焙烧α-锂辉石的目的为___。
(2)滤渣2的主要成分为___,调节pH值的范围为___。
(3)“除大部分Mg”步骤的离子方程式为___。
(4)实验室蒸发浓缩操作中所需的仪器为酒精灯、铁架台(带铁圈)、___。
(5)洗涤过程中检验沉淀是否洗涤干净的操作为___。
(6)碳酸锂是制备锂离子电池的原料之一,某锂离子电池以CoP3作为负极材料,以LiMn1.5Ni0.5O4作为正极材料,以可传导放电Li+的无机固体电解质c-LATP作为电解液,其工作时电池反应为Li1-xMn1.5N0.5O4+Lix(CoP3)n![]() LiMn1.5Ni0.5O4+(CoP3)n,则该电池放电时负极的电极反应式为___,充电时阳极的电极反应式为___。
LiMn1.5Ni0.5O4+(CoP3)n,则该电池放电时负极的电极反应式为___,充电时阳极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠与工农业生产、日常生活紧密相关。工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品往往含有少量的NaCl,现欲测定碳酸钠样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀________(填操作名称)、洗涤、烘干、称量。洗涤沉淀的操作是________________________________________.
方案二:气体分析法
(2)用如图所示装置,将一定质量的样品与足量盐酸反应,并测定产生CO2气体的体积,为了使测量结果准确,B中的溶液最好采用________(填字母)。
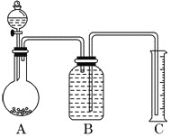
a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液
c.饱和氢氧化钠溶液 d.氯化钠溶液
但选用该溶液后实验结果仍然不够准确,原因是________________________________
方案三:质量差分析法
(3)采用如图所示装置,将一定质量的样品与足量的稀硫酸反应,通过称量反应前后盛有碱石灰的干燥管的质量,利用其质量差计算样品的纯度。
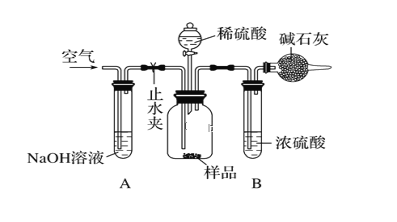
该实验的操作步骤:
①在干燥管内装满碱石灰,质量为m1g ②取ng样品装入广口瓶中 ③检查装置的气密性 ④缓慢鼓入空气数分钟,再称量干燥管质量为m2g ⑤关闭止水夹 ⑥打开止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓入空气数分钟
Ⅰ.正确的操作顺序是(填序号):③→_____→⑥→_____→⑤→________→⑦→________→④。
Ⅱ.在操作④中,要缓慢鼓入空气数分钟,鼓入空气的作用是________________;装置 B的作用是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中A、B是盐,C是碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为_____________。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为_______
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸
① B的化学式为_____________,鉴别溶液B中的阴离子的方法:___________________
② D溶于稀硝酸的离子方程式为________________________________
③ D与E的混合物a g,加入足量盐酸,完全反应生成的气体在标准状况下体积为b L,则求算E在混合物中的质量分数的表达式为________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:mCeO2 (m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2
(m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO

下列说法不正确的是( )
A.该过程中CeO2没有消耗B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3D.H2(g)+O2(g)=H2O(g)的反应热大于ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z 四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
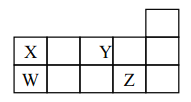
A. 四种元素中原子半径最大为 W, Y 的氢化物稳定性最强
B. 四种元素最高价氧化物的水化物都是酸
C. XZ4、 WY2中所含化学键类型相同,熔点都很高
D. W、 X 形成的单质都是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、NH4+、Fe2+、K+、SO32-、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
A.肯定不含K+
B.肯定含有SO32-、K+
C.肯定不含SO42-
D.肯定含有NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com