
【题目】碲(![]() )元素在元素周期表中位于第
)元素在元素周期表中位于第![]() 族,其单质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是
族,其单质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是![]() 、含
、含![]() 等杂质)中提取单质碲,步骤如下:
等杂质)中提取单质碲,步骤如下:
①将铜阳极泥在空气中焙烧使碲转化为![]() ;
;
②用![]() 溶液碱浸;
溶液碱浸;
③以石墨为电极电解②所得溶液获得![]() 。
。
已知:![]() 微溶于水,易与较浓的强酸、强碱反应。
微溶于水,易与较浓的强酸、强碱反应。
下列说法不正确的是
A.![]() 中,
中,![]() 的化合价是-2
的化合价是-2
B.步骤②中,碱浸的离子方程式是![]()
C.步骤③中,阴极上发生反应的电极方程式是:![]()
D.在阳极区溶液中检验出有![]() 存在,可能原因是阳极生成的氧气氧化
存在,可能原因是阳极生成的氧气氧化![]() 得到
得到![]()
科目:高中化学 来源: 题型:
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示(SO![]() 、OH表示自由基)。设阿伏加德罗常数的值为NA。下列叙述错误的是( )
、OH表示自由基)。设阿伏加德罗常数的值为NA。下列叙述错误的是( )

A.过硫酸钠中-2价氧与-1价氧的个数比为3:1
B.若56gFe参加反应,共有1.5NA个S2O82被还原
C.碱性条件下硫酸根自由基发生反应的方程式为SO4-+OH-=SO42-+OH
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下:
CH3OH(g)+ 3/2O2(g) =CO2(g)+2H2O(1) ΔH1=a kJ·mol1
H2(g)+1/2O2(g) =H2O(1) ΔH2=b kJ·mol1
H2O(g) = H2O(l) ΔH3=c kJ·mol1
则 CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=_______kJ·mol1
CH3OH(g)+H2O(g) ΔH=_______kJ·mol1
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g) ΔH,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
2CO(g) ΔH,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
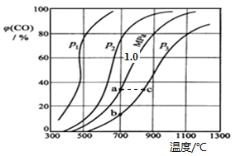
回答下列问题:
①压强p1、p2、p3的大小关系是______;Ka 、 Kb 、 Kc 为a、b、c三点对应的平衡常数,则其大小关系是______。
②900℃、1.0 MPa时,足量碳与a molCO2反应达平衡后,CO2的转化率为________ (保留三位有效数字),该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸,CO2(g)+CH4(g) ![]() CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是_______。
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是_______。
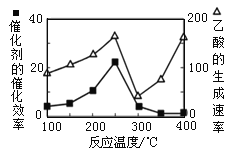
(4)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为__________;每生成0.5mol乙烯,理论上需消耗铅蓄电池中_____mol硫酸。
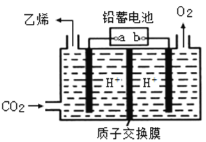
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.23gNO2与足量水反应,转移的电子数约为6.02×1023
B.标准状况下,22.4L15NH3含有的质子数约为6.02×1024
C.常温下,1L0.1mo1L-1NH4NO3溶液中含有的NH4+数约为6.02×1022
D.密闭容器中,1molNO与0.5molO2充分反应后,容器中分子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。C是海水中最多的盐,D是常见的无色液体。E和G为无色气体,其中E能使湿润的红色石蕊试纸变蓝。B、C、I、J的焰色反应为黄色,其中I可用于制发酵粉或治疗胃酸过多。

⑴F的化学式为______。E的电子式为______。
⑵写出反应①的离子方程式:______。
⑶写出反应②的化学方程式:______。
⑷写出反应③的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,可用于制备丙烯、氢气等。
(1)MTO法由甲醇制备丙烯时的反应原理是:甲醇先脱水生成二甲醚,然后二甲醚与甲醇的平衡混合物脱水转化为含丙烯较多的低聚烯烃。某温度下,在密闭容器中加入CH3OH气体,发生脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
物质 | CH3OH | CH3OCH3 | H2O |
5min浓度(mol·L-1) | 0.44 | 0.6 | 0.6 |
10min浓度mol·L-1) | 0.04 | 0.8 | 0.8 |
15min浓度(molL-1) | 0.04 | 0.8 | 0.8 |
该温度下,反应的平衡常数数值是___,CH3OH的平衡转化率是___。
(2)利用甲醇水蒸气重整制氢法是获得氢气的重要方法。反应原理如下:
反应i(主反应):CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+49kJmol-1
CO2(g)+3H2(g)△H=+49kJmol-1
反应ii(副反应):H2(g)+CO2(g)![]() CO(g)+H2O(g)△H=+41kJmol-1
CO(g)+H2O(g)△H=+41kJmol-1
①温度高于300℃则会同时发生CH3OH转化为CO和H2的副反应,该反应的热化学方程式是___。
②反应中,经常使用催化剂提高化学反应速率,但催化剂对反应具有选择性。一定条件下,测得CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

从图中可知,反应的适宜温度为___,随着温度的升高,催化剂对___(填“反应i”或“反应ii”)的选择性越低。
③TiO2纳米电极电化学还原法可将副产物CO2在酸性水溶液中电解生成甲醇,生成甲醇的电极反应式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置验证SO2的某些性质(加热及夹持装置略去)。
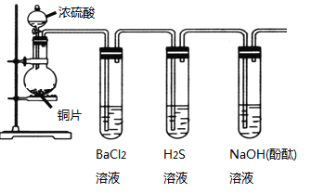
(1)装有浓硫酸的仪器名称是____________。
(2)铜与浓硫酸反应的化学方程式是____________________________________。
(3)能验证SO2具有氧化性的实验现象是_____________________________。
(4)装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是______,_____。
(5)写出SO2显示还原性并生成白色沉淀的总的离子方程式____________________________。
(6)能验证SO2具有酸性氧化物的通性的实验现象_____。若通入过量的SO2,则其总反应的离子反应方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.0.1molNH3中含有中含有的原子数为0.3NA
B.0.2molNaCl中含有的离子总数为0.2NA
C.9.8g H2SO4即为0.1mol H2SO4
D.1molH2O中含有2mol氢和1mol氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA 表示阿伏加德罗常数)
消耗二氧化碳 | 生成碳酸钠 | 转移的电子 | |
A | 1 mol | 2NA | |
B | 22.4 L | 1 mol | |
C | 106 g | 1 mol | |
D | 106 g | 2NA |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com