
【题目】下列说法正确的是 ( )
A.0.1molNH3中含有中含有的原子数为0.3NA
B.0.2molNaCl中含有的离子总数为0.2NA
C.9.8g H2SO4即为0.1mol H2SO4
D.1molH2O中含有2mol氢和1mol氧
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO (慢):②FeO++CO=CO2+Fe+ (快)。下列说法正确的是
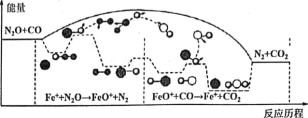
A. 反应①是氧化还原反应,反应②是非氧化还原反应
B. 两步反应均为放热反应,总反应的化学反应速率由反应②决定
C. Fe+使反应的活化能减小,FeO+是中间产物
D. 若转移lmol电子,则消耗II.2LN2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(![]() )元素在元素周期表中位于第
)元素在元素周期表中位于第![]() 族,其单质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是
族,其单质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是![]() 、含
、含![]() 等杂质)中提取单质碲,步骤如下:
等杂质)中提取单质碲,步骤如下:
①将铜阳极泥在空气中焙烧使碲转化为![]() ;
;
②用![]() 溶液碱浸;
溶液碱浸;
③以石墨为电极电解②所得溶液获得![]() 。
。
已知:![]() 微溶于水,易与较浓的强酸、强碱反应。
微溶于水,易与较浓的强酸、强碱反应。
下列说法不正确的是
A.![]() 中,
中,![]() 的化合价是-2
的化合价是-2
B.步骤②中,碱浸的离子方程式是![]()
C.步骤③中,阴极上发生反应的电极方程式是:![]()
D.在阳极区溶液中检验出有![]() 存在,可能原因是阳极生成的氧气氧化
存在,可能原因是阳极生成的氧气氧化![]() 得到
得到![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤、石油、天然气目前依然是我国的主要能源。它们在氧气不足时会不完全燃烧:2C+O2 ![]() 2CO,烃在氧气不足时也会不完全燃烧。
2CO,烃在氧气不足时也会不完全燃烧。
(1)完成下列方程式:2CxHy +___O2 ![]() aCO +___CO2 +___H2O
aCO +___CO2 +___H2O
(2)H 原子的电子排布式是“1s1”,它未表明电子运动状态的方面是________(填编号)。
a. 电子层 b. 电子亚层 c. 电子云的伸展方向 d. 电子的自旋
(3)上述反应中半径最大的原子核外有______种能量不同的电子,写出其最外层轨道表示式______。
(4)石油和煤的綜合利用中,下列说法错误的是______。
a.近年我国在新疆等地发现的石油矿藏超几十亿吨说明石油取之不尽
b.石油裂解目的是提高汽油的产量和质量
c.煤的液化和煤的气化都属于化学变化、石油的减压分馏属于物理変化
d.石油、煤、天然气都可以通过管道运输节约运输成本
(5)碳元素与氧元素的非金属性强弱的是 C______O(填“>”或“<”)。
(6)写出一个事实比较碳与硫非金属性强弱______。
(7)煤的气化是煤高效洁净利用的方向之一。在一定温度下的恒容密闭容器中建立下列化学平衡:C(s)+H2O(g)CO(g)+H2(g)—Q,该反应的平衡常数表达式______,可认定该可逆反应在一定条件下已达到化学平衡状态的 是______ 。(选填序号)
a. 体系的压强不再发生变化 b. 生成 n mol CO 的同吋生成 n mol H2
c. v 正(CO)=v 逆(H2) d. 1mol H-H 键断裂同吋断裂 1mol H-O 键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α—甲基苯乙烯(AMS)在有机合成中用途广泛,以下是用苯为原料合成AMS,并进一步制备香料龙葵醛的路线:
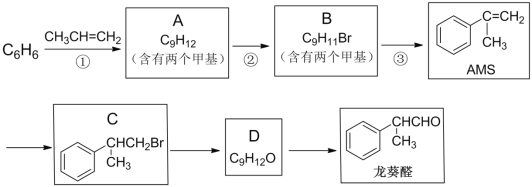
完成下列填空:
(1)反应①的反应类型是____;反应③所需的试剂与条件是____。
(2)写出反应②的化学方程式:____。
(3)AMS可以自身聚合,写出该高聚物的结构简式:____。
(4)写出同时满足下列条件的龙葵醛的一种同分异构体的结构简式:____。
i. 苯环上的一氯代物有两种
ii. 分子中没有甲基
iii. 能与金属钠产生H2
(5)有人认为仅用反应②就能得到C,事实证明产物中C的含量远远小于B。由该事实可以得到的结论是____。
(6)设计一条由AMS合成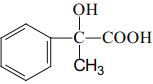 的合成路线____。(合成路线常用的表示方式为:A
的合成路线____。(合成路线常用的表示方式为:A ![]() B。。。
B。。。![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1molH2(g)中的H-H键需要消耗436kJ能量,如图反应3H2(g)+N2(g) ![]() 2NH3(g)的能量变化示意图.下列说法不正确的是
2NH3(g)的能量变化示意图.下列说法不正确的是

A. 断开1 mol N2(g)中的N![]() N键要吸收941 kJ能量
N键要吸收941 kJ能量
B. 生成2mol NH3(g)中的N-H键吸收2346 kJ能量
C. 3H2(g) + N2(g) ![]() 2NH3(g) △H=-97
2NH3(g) △H=-97![]()
D. NH3(g) ![]() 3/2H2(g) +1/2 N2(g) △H=48.5
3/2H2(g) +1/2 N2(g) △H=48.5 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A.25℃、101Kpa时,64g SO2中含有的原子数为3NA
B.常温常压下,1mol氢气含有的原子数为2NA
C.在标准状况下,11.2L H2O含有的分子数0.5NA
D.5.6g金属铁与足量盐酸反应,失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
元素 | T | X | Y | Z |
性质结构信息 | 人体内含量最多的元素,且其单质是常见的助燃剂。 | 单质为空气中含量最多的气体,该气体为双原子分子,分子中含有3对共用电子对。 | 单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 | 第三周期的金属元素,其氧化物有两性。 |
(1)元素T的离子结构示意图_____;元素X的气态氢化物的电子式____;Y的最高价氧化物的水化物属于____化合物(填“离子”或“共价”)。
(2)Z的最高价氧化物对应水化物的电离方程式_________。
(3)元素Z与镁元素相比,金属性较强的是___(用元素符号表示),下列表述中不能证明这一事实的是_____。
a.氢氧化镁不溶于氢氧化钠,而氢氧化铝可溶于氢氧化钠
b.镁能置换出熔融氧化铝中的铝
c.镁能跟二氧化碳反应,而铝不能
d.等量的镁铝和足量的盐酸反应时,铝失电子的数目比镁多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,定容密闭容器中0.4mol/LN2,1mol/LH2进行反应:N2(g)+ 3H2(g)![]() 2NH3(g),10min反应达到平衡,此时测得N2浓度为0.2mol/L。
2NH3(g),10min反应达到平衡,此时测得N2浓度为0.2mol/L。
(1)10min内,用H2浓度变化来表示的反应速率为___,平衡时NH3的物质的量浓度为____;
(2)能判断该反应达到化学平衡状态的依据是____
A.容器中密度不随时间变化而变化 B.容器中各物质的浓度保持不变
C.N2和NH3的消耗速率之比为2∶1 D.N2消耗速率与H2生成速率之比为3:1
(3)平衡时N2和H2的转化率之比为____;该反应的平衡常数表达式为K=____,该温度下反应的平衡常数是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com