
【题目】用NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A.25℃、101Kpa时,64g SO2中含有的原子数为3NA
B.常温常压下,1mol氢气含有的原子数为2NA
C.在标准状况下,11.2L H2O含有的分子数0.5NA
D.5.6g金属铁与足量盐酸反应,失去的电子数为0.2NA
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下:
CH3OH(g)+ 3/2O2(g) =CO2(g)+2H2O(1) ΔH1=a kJ·mol1
H2(g)+1/2O2(g) =H2O(1) ΔH2=b kJ·mol1
H2O(g) = H2O(l) ΔH3=c kJ·mol1
则 CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=_______kJ·mol1
CH3OH(g)+H2O(g) ΔH=_______kJ·mol1
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g) ΔH,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
2CO(g) ΔH,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
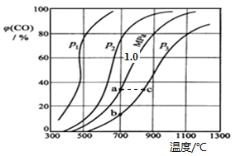
回答下列问题:
①压强p1、p2、p3的大小关系是______;Ka 、 Kb 、 Kc 为a、b、c三点对应的平衡常数,则其大小关系是______。
②900℃、1.0 MPa时,足量碳与a molCO2反应达平衡后,CO2的转化率为________ (保留三位有效数字),该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸,CO2(g)+CH4(g) ![]() CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是_______。
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是_______。
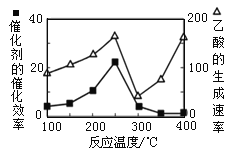
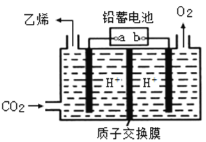
(4)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为__________;每生成0.5mol乙烯,理论上需消耗铅蓄电池中_____mol硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置验证SO2的某些性质(加热及夹持装置略去)。
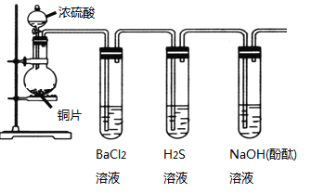
(1)装有浓硫酸的仪器名称是____________。
(2)铜与浓硫酸反应的化学方程式是____________________________________。
(3)能验证SO2具有氧化性的实验现象是_____________________________。
(4)装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是______,_____。
(5)写出SO2显示还原性并生成白色沉淀的总的离子方程式____________________________。
(6)能验证SO2具有酸性氧化物的通性的实验现象_____。若通入过量的SO2,则其总反应的离子反应方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.0.1molNH3中含有中含有的原子数为0.3NA
B.0.2molNaCl中含有的离子总数为0.2NA
C.9.8g H2SO4即为0.1mol H2SO4
D.1molH2O中含有2mol氢和1mol氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺贝尔奖获得者屠呦呦带领团队发现了青蒿素,为中国医药科技创新和人类健康事业作出了巨大贡献,我国化学家在确认青蒿素分子结构后实现了青蒿素的全合成。一种以香茅醛为原料合成青蒿素的流程如图:
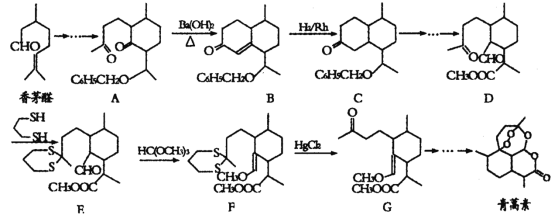
已知:羰基α—H可发生反应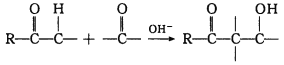
回答下列问题:
(1)青蒿素的分子式为__。根据青蒿素所含官能团,推测其可能具有的性质有___。
a.易溶于水 b.具有氧化性 c.可发生水解反应
(2)香茅醛的同分异构体X含有醛基和六元碳环,且环上只有一个支链,满足上述条件的X有__种,其中核磁共振氢谱峰数最少的物质结构简式为__。
(3)反应A→B实际上可看作两步进行,依次发生的反应类型是__、__。
(4)C中所含官能团名称为__。
(5)通过D→E的反应,分子中引入了硫醚基团,而F→G的反应,分子中硫醚基团又被脱去,这样做的目的是__。
(6)写出由苯甲醛和氯乙烷为原料,制备苄基乙醛(![]() )的合成路线流程__(无机试剂任选)。
)的合成路线流程__(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用下图装置进行实验,试回答:
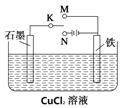
(1)若开始时K接M,则该装置为________(填“原电池”或“电解池”),铁极上的电极反应式为__________________。
(2)若开始时K接N,则石墨极为______极(填“正”、“负”、“阳” 或“阴”),石墨电极的电极反应式为______________________,铁极上的现象为_____________,若反应过程中有0.2mol的电子发生转移,则铁电极上产生物质的质量为________g,石墨极上产生的物质在标准状况下的体积为_____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含 Mg2B2O5·H 2O、SiO2 及少量 Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:

已 知 :H3BO3+H2O![]() H++B(OH)
H++B(OH)![]() ,Ka = 5.81×10 10
,Ka = 5.81×10 10
(1)“吸收”过程中反应的化学方程式为_________________________________。
(2)“滤渣 1”的主要成分有_____。
(3)为检验“过滤 1”后的滤液中是否含有 Fe3+离子,可选用的化学试剂是____________________________。
(4)在“过滤 2”前,将溶液 pH 调节至 3.5,目的是_____。
(5)在“沉镁”中生成 Mg(OH)2·MgCO3 沉淀的离子方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA 表示阿伏加德罗常数)
消耗二氧化碳 | 生成碳酸钠 | 转移的电子 | |
A | 1 mol | 2NA | |
B | 22.4 L | 1 mol | |
C | 106 g | 1 mol | |
D | 106 g | 2NA |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子结构中各种化学键如图所示,关于乙醇在各种反应中断键的说明不正确的
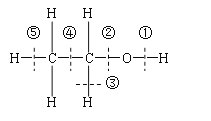
A.和金属钠反应是键①断裂
B.和浓氢溴酸混合加热时断键②
C.和浓硫酸共热到170℃时断键②和⑤
D.和浓硫酸共热到140℃时仅断键②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com